
 不变
不变 不变
不变
 不变 醋酸的电离程度增大,n(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,n(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
 不变 醋酸的电离程度增大,C.(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,C.(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
 不变 醋酸的电离程度增大,c(H+)亦增大 再加入9mLpH=11的NaOH溶液,混合液pH <7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入9mLpH=11的NaOH溶液,混合液pH <7
 不变
不变
 不变 醋酸的电离程度增大,c(H+)亦增大 醋酸的电离常数K.随醋酸浓度减小而减小
不变 醋酸的电离程度增大,c(H+)亦增大 醋酸的电离常数K.随醋酸浓度减小而减小
 变大 醋酸的电离程度增大,c(OH-)亦增大 再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应
变大 醋酸的电离程度增大,c(OH-)亦增大 再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应
 不变 醋酸的电离程度增大,c(H+)亦增大 醋酸的电离常数K.随醋酸浓度减小而减小
不变 醋酸的电离程度增大,c(H+)亦增大 醋酸的电离常数K.随醋酸浓度减小而减小
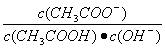 不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mLpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mLpH=11的NaOH溶液,混合液pH=7
 不变 醋酸的电离常数K.随醋酸浓度减小而减小
不变 醋酸的电离常数K.随醋酸浓度减小而减小
 不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
 变小 醋酸的电离程度增大,c(OH-)亦增大
变小 醋酸的电离程度增大,c(OH-)亦增大  不变
不变