你可能感兴趣的试题
c(Na+)=c(CH3COO—) c(CH3COO—)+c(CH3COOH)=0.1 mol·L-1 由水电离出来的c(OH—)=1.0×10-11mol·L-1 往该溶液中加入0.05 mol·L-1的CH3COONa,pH值变大
把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) 把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c (OH-) >c (Ba+)>c (Na+)> c (H+) 向1 mol/L 的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度 相同
将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀 已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] 0.1mol/L的氨水的pH=a,0.01 mol/L的氨水的pH=b,则a-1>b 0.1mol/L CH3COONa溶液中通入HCl气体至溶液的pH恰好等于7,则c(Na+)>c(CH3COOH)= c(Cl-)
pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)3)3COONa) 已知25° 时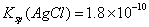 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
加入少量NaOH固体后溶液pH小于9
加水稀释,CH3COONa水解程度增大,c(OH-)增大 该溶液水电离出的c(OH-)== 10-5 mol/L 通入一定体积的HCl气体,CH3COONa水解程度增大,溶液碱性增强。
把a L 0.1 mol/L 的CH3COOH溶液与b L 0.1 mol/L的 KOH溶液混合,所得溶液中一定存在:c (K+)+ c (H+) = c (CH3COO-) + c (OH-) 把0.1 mol/L 的NaHCO3溶液与0.3 mol/L 的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c (OH-) >c (Ba2+)>c (Na+)> c (H+) 向1 mol/L 的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)3)3COONa) 已知25° 时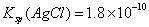 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有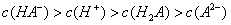
物质的量浓度均为0.1mol/L,3种溶液pH的大小顺序是③>②>① 物质的量浓度均为0.1 mol/L,将3种溶液稀释相同倍数,pH变化最大的是② 物质的量浓度均为0.1mol/L,分别加入25mL 0.1mol/L盐酸后,pH最大的是① pH均为9时,3种溶液的物质的量浓度的大小顺序是③>①>②
升高温度,平衡正向移动,醋酸的电离常数Ka增大 0.10 mol/L.的CH3COOH 溶液加水稀释,溶液中c(OH-)增大 CH3COOH.溶液加少量的CH3COONa固体,平衡逆向移动 室温下,欲使0.1 mol/L.醋酸溶液的pH、电离度α都减小,可加入少量水
pH相等的NaOH、CH3COONa和NaHCO3三种溶液,则有c(NaOH)3)3COONa) 已知25° 时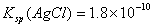 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到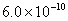 mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
以上实验数据都可以说明CH3COONa溶液中存在水解平衡 CH3COONa水解平衡常数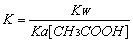 在室温将0.1mol/L CH3COONa溶液加水稀释到0.01mol/L,pH由8.75变化到8.27,可以说明0.1mol/LCH3COONa溶液水解程度更大 加热0.1mol/L的CH3COONa溶液,pH的变化可说明温度升高,K.增大
在室温将0.1mol/L CH3COONa溶液加水稀释到0.01mol/L,pH由8.75变化到8.27,可以说明0.1mol/LCH3COONa溶液水解程度更大 加热0.1mol/L的CH3COONa溶液,pH的变化可说明温度升高,K.增大
0.1mol·L-1Na2CO3溶液中:=++ 0.1mol·L-1CH3COONa溶液中:=+ CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序: c (NaOH) <c (Na2CO3) <c(CH3COONa) 向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:>>=
把a L0.1 mol/L.的CH3COOH溶液与b L0.1 mol/L.的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO一)+c(OH一) 把0.1 mol/L.的NaHC03溶液与0.3 mol/L.的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH一)>c(Ba2+)>c(Na+)>c(H+) 向1 mol/L.的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
用0.2 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸被完全中和 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后呈酸性,所得溶液中:  室温下,pH= 2 的盐酸与pH= 12的氨水等体积混合,所得溶液中:
室温下,pH= 2 的盐酸与pH= 12的氨水等体积混合,所得溶液中:  0.1 mol·L-1 pH=4的NaHB的溶液中,c(Na+) >c(HB-)> c(H2B)>c(B2-)
0.1 mol·L-1 pH=4的NaHB的溶液中,c(Na+) >c(HB-)> c(H2B)>c(B2-)
①和②分别稀释100倍后的pH: ①> ② 水电离出的c(OH-):④>③> ① > ② ①和③混合后溶液呈中性:c(Na+) /c(CH3COO-) < 1 ①和④混合后溶液呈酸性:c(Na+) / c(CH3COO-)>1

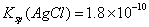 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
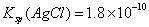 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有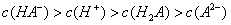
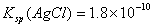 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到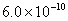 mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
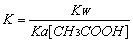 在室温将0.1mol/L CH3COONa溶液加水稀释到0.01mol/L,pH由8.75变化到8.27,可以说明0.1mol/LCH3COONa溶液水解程度更大 加热0.1mol/L的CH3COONa溶液,pH的变化可说明温度升高,K.增大
在室温将0.1mol/L CH3COONa溶液加水稀释到0.01mol/L,pH由8.75变化到8.27,可以说明0.1mol/LCH3COONa溶液水解程度更大 加热0.1mol/L的CH3COONa溶液,pH的变化可说明温度升高,K.增大
 室温下,pH= 2 的盐酸与pH= 12的氨水等体积混合,所得溶液中:
室温下,pH= 2 的盐酸与pH= 12的氨水等体积混合,所得溶液中:  0.1 mol·L-1 pH=4的NaHB的溶液中,c(Na+) >c(HB-)> c(H2B)>c(B2-)
0.1 mol·L-1 pH=4的NaHB的溶液中,c(Na+) >c(HB-)> c(H2B)>c(B2-)