你可能感兴趣的试题
0.1 mol•L-1NaHCO3溶液: K+、Fe3+、Cl-、NO3- 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ 常温下由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Na+、SO32-、NO3- 常温下在c(H+)=1×10-13mol·L-1的溶液中: Na+、K+、SO42-、CO32-
该溶液lmL稀释至100mL后,pH等于3 向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 该溶液中硝酸电离出的c(H++H.)与水电离出c(H++H.)的之比值为10-12 该溶液中水电离出的c(H++H.)是pH为3的硝酸中水电离出的c(H++H.)的100倍
该溶液1 mL稀释至100 mL后,pH小于3 向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 该溶液中硝酸电离出的c(H+)与水电离出的c(H+)的比值为10-12 该溶液中水电离出c(H+)是pH为3的硝酸中水电离出c(H+)的100倍
该溶液1 mL稀释至100 mL后,pH小于3 向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12 该溶液中水电离出c(H+)是pH为3的硝酸中水电离出c(H+)的100倍
pH=6.5的溶液一定显酸性 0.1mol • L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol • L-1 常温下,等体积的0.2 mol • L-1的盐酸与0.2 mol • L-1的氢氧化钡溶液混合,所得溶液的pH=13 常温下,某溶液中水电离出的c(OH-)=l×10-12 mol • L-1,该溶液pH 一定等于2
溶液中水电离出的c(H+)=10-10 mol/L 溶液中c(H+)+c(A-)=0.1 mol/L 溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为 c(A-)>c(Na+)>c(OH-)>c(H+)
该溶液1 mL稀释至100 mL后,pH等于2 向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 该溶液中硝酸电离出的c(H.+)与水电离出的c(H.+)之比值为10-12 该溶液中水电离出的c(H.+)是pH为3的硝酸中水电离出的c(H.+)的100倍
a点溶液中:水电离出的c(H+)=1×10-10mol/L b点溶液中:c(H+)=1×10-7mol/L c点溶液中:c(Na+)>c(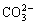 )>c(
)>c( ) d点溶液中:c(Na+)=2c(
) d点溶液中:c(Na+)=2c(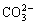 )+c(
)+c( )
)
将10 mL该溶液稀释至100 mL后,pH小于3 向该溶液中加入等体积pH为12的氨水恰好完全中和 该溶液中酸电离出的c(H+)与水电离出的c(H+)之比为1010∶1 该溶液中由水电离出的c(H+)水·c(OH-)水=1×10-14
常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-) 常温下0.1 mol.L.-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L.-l 常温下向10 mL0.1 mol.L.-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中, 将减小
将减小
该溶液1 mL稀释至100 mL后,pH大于3 向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 该溶液中硝酸电离出的[H+]与水电离出的[H+]的比值为10-12 该溶液中水电离出的[H+]是pH为3的硝酸中水电离出的[H+]的100倍
甲、乙两溶液的pH不可能相同 甲、乙两种溶液中加入Al粉都一定会产生H2 HCO3-不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
甲中水电离出来的H+的物质的量浓度是乙中水电离出来的H+的物质的量浓度的10倍 物质的量浓度c(甲)>10c(乙) 中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,V.(甲)=10V(乙) 甲中的c(OH-)为乙中的c(OH-)的10倍
常温下,pH等于14与pH等于12的两种NaOH溶液等体积混合后, c(H+)=(10-14+10-10)/2 常温下,浓度为1×10-10 mol·L.-1的KOH溶液的pH为7 氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 常温下,pH等于1的盐酸溶液中水的电离程度与pH等于13的Ba(OH)2溶液中水的电离程度相等

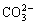 )>c(
)>c( ) d点溶液中:c(Na+)=2c(
) d点溶液中:c(Na+)=2c(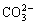 )+c(
)+c( )
)
 将减小
将减小