你可能感兴趣的试题
pH = 1的盐酸与pH = 13的Ba(OH)2溶液 0.1 mol ・ L 1 HCl溶液与0.1 mol ・ L 1氨水 pH = 1的CH3COOH溶液与pH = 13的NaOH溶液 0.1 mol ・ L 1CH3COOH溶液与0.1mol ・ L 1 NaOH溶液
10mL0.1mol・L-1氨水与10mL0.1mol・L-1盐酸混合:[Cl-]>[NH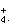 ]>[OH-]>[H+]
]>[OH-]>[H+]
10mL0.1mol・L-1NH4Cl溶液与5mL0.2mol・L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
10mL0.1mol・L-1CH3COOH溶液与5mL0.2mol・L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
10mL0.5mol・L-1CH3COONa溶液与6mL1mol・L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
0.1 mol・L-1CH3COOH溶液加水稀释,溶液中c(H+)和c(OH-)都减少 0.1 mol・L-1CH3COOH溶液中加入CH3COONa固体,溶液中c(CH3COO-)减少 0.1 mol・L-1 CH3COONa溶液中:c(OH-) = c(CH3COOH) + c(H+) 相同浓度的CH3COONa溶液与Na2CO3溶液相比,Na2CO3溶液的pH小
自来水
0.5mol・L-1盐酸
0.5mol・L-1CH3COOH溶液
0.5mol・L-1KCl溶液
1L. 0.3 mol/L CH3COOH溶液和3L. 0.1 mol/L CH3COOH溶液中的H.+数 pH=1的CH3COOH溶液和盐酸的物质的量浓度 pH=12的氨水和NaOH溶液的导电能力 pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积
c(H+)>C.(OH-) c(CH3COOH)+c(CH3COO-)=0.1 mol・L-1 c(CH3COOH)>c(CH3COO-) c(CH3COO-)+c(OH-)=0.2 mol・L-1
混合液中:c(Na+) = c(CH3COO-) 原醋酸的物质的量浓度大于0.01 mol ・ L 1 原醋酸中c(H+)小于0.01 mol ・ L 1 混合液中:c(CH3COOH) + c(CH3COO-) = 0.005 mol ・ L 1
[CH3COO-]>[Na+]
[CH3COOH]>[CH3COO-]
2[H+]=[CH3COO-]-[CH3COOH]
[CH3COOH]+[CH3COO-]=0.1mol・L-1
c(H+)c(CH3COOH)+c(CH3COO-)=0.2mol/L c(CH3COOH) >c(CH3COO-) c(CH3COO-)+ c(OH-)=0. 1mol/L
混合液中c(Na+)=c(CH3COO-) 该醋酸溶液中c(H+)=0.01 mol・L.-1 该醋酸溶液的物质的量浓度大于0.01 mol・L.-1 混合液中c(CH3COOH)+c(CH3COO-)=0.005 mol・L.-1
0.1mol・L.-1氨水中,c(OH-)=c(NH4+) 10 mL 0.02mol・L.-1HCl溶液与10 mL 0.02mol・L.-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 在0.1mol・L.-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) 0.1mol・L.-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A.)
中和时所需NaOH的量 电离程度 H+的物质的量 CH3COOH的物质的量
488.3kJ・mol-1 -244.15kJ・mol-1 -488.3kJ・mol-1 244.15 kJ・mol-1
向NH4Cl溶液中加入一定量的氨水,有可能c(OH-)=c(NH4+) 在常温下,10 mL 0.02mol・L-1HCl溶液与10 mL 0.02mol・L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 在0.1mol・L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) 0.1mol・L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A.)
[H+]>[OH-]
[CH3COOH]+[CH3COO-]=0.2 mol・L-1
[CH3COOH]>[CH3COO-]
[CH3COO-]+[OH-]=0.2 mol・L-1
488.3 kJ・mol-1 -244.15 kJ・mol-1 244.15kJ・mol-1 -488.3kJ・mol-1

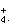 ]>[OH-]>[H+]
]>[OH-]>[H+]