你可能感兴趣的试题
电导率传感器能用于判断酸碱中和滴定的终点 该过程中,a点所示溶液的导电性最强 c点电导率最小是因为此时溶液中导电微粒的数目最少 d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+)
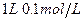 醋酸
醋酸 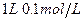 硫酸 0.5L0.1mol/L盐酸 2L0.1moL/L的磷酸
硫酸 0.5L0.1mol/L盐酸 2L0.1moL/L的磷酸
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,c(H+)亦增大 再加入10mL pH=11 NaOH溶液,混合液pH=7 溶液中 不变
不变
1L0.1mol/L.醋酸 0.1L 0.1mol/L H2SO4溶液 0.5L 0.1mol/L.盐酸 2L 0.1mol/L H2SO3溶液
5L 0.1 mol ·L-1NH3·H2O 5L mol ·L-1 盐酸 0.1L 0.1 mol ·L-1H3PO4溶液 0.1L 0.1 mol ·L-1 Ba(OH)2溶液
强电解质溶液的导电性一定比弱电解质溶液的导电性强 强电解质都是离子化合物,而弱电解质都是共价化合物 强电解质在稀的水溶液中全部以离子的形态存在 水溶液中导电能力差的电解质一定是弱电解质
开始时,导电能力肯定最强 当沉淀为最大值时,导电性最弱
先变强,后变弱 逐渐变弱
电导率传感器能用于判断酸碱中和滴定的终点 该过程中,a点所示溶液的导电性最强 c点电导率最小是因为此时溶液中导电微粒的数目最少 d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+)
溶液中导电粒子的数目增加,导电性增强 氨水的电离程度增大,[OH-]减小 再加入10mL pH=3 HCl溶液,混合液pH=7 溶液中由水电离出的[OH-]=1×10-3 mol·L-1
强、弱电解质的导电性只由它的浓度决定
电解质的强、弱与导电性没有本质的联系
强电解质的导电能力强,弱电解质的导电能力弱
导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,减小 再加入10mL pH=11 NaOH溶液,混合液pH=7 溶液中由水电离出的=1×10-11 mol·L-1
开始时,导电能力肯定最强 当沉淀为最大值时,导电性最弱
先变强,后变弱 逐渐变弱
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,c(H+)亦增大 再加入10mL pH=11 NaOH溶液,混合液pH=7 溶液中 不变
不变
1L0.1mol/L醋酸 0.1L 0.1mol/L H2SO4溶液 0.5L 0.1mol/L盐酸 2L 0.1mol/L H2SO3溶液
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,[H+]减小 再加入10mLpH=11NaOH 溶液,混合液pH=7 溶液中由水电离出的[H+]=1×10-11mol/L

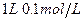 醋酸
醋酸 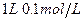 硫酸 0.5L0.1mol/L盐酸 2L0.1moL/L的磷酸
硫酸 0.5L0.1mol/L盐酸 2L0.1moL/L的磷酸
 不变
不变
 不变
不变