
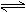 +2B(g) C.(g)+2D(g)已达到平衡状态( ) A.混合气体的压强 混合气体的密度 各气体的物质的量 气体的总物质的量
+2B(g) C.(g)+2D(g)已达到平衡状态( ) A.混合气体的压强 混合气体的密度 各气体的物质的量 气体的总物质的量
 C(g)+D.(g) 已达到平衡状态的是( ) ①混合气体的压强,②混合气体的密度,③ 的物质的量浓度,④气体的总物质的量, ⑤混合气体的平均相对分子质量,⑥v( )与v( )的比值 A.②③⑤ B.①②③ C.②③④⑥ D.①③④⑤
C(g)+D.(g) 已达到平衡状态的是( ) ①混合气体的压强,②混合气体的密度,③ 的物质的量浓度,④气体的总物质的量, ⑤混合气体的平均相对分子质量,⑥v( )与v( )的比值 A.②③⑤ B.①②③ C.②③④⑥ D.①③④⑤
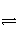
 C.(g)+D.(g)已达到平衡状态的是 ( ) A.混合气体的密度 混合气体的总物质的量 混合气体的压强 混合气体的总体积
C.(g)+D.(g)已达到平衡状态的是 ( ) A.混合气体的密度 混合气体的总物质的量 混合气体的压强 混合气体的总体积
 C.(g)+D.(g)已达到平衡状态 ①各气体物质的物质的量浓度 ②气体的总物质的量 ③混合气体的压强 ④混合气体的密度 A.只有①② 只有①④ 只有①③④ ①②③④
C.(g)+D.(g)已达到平衡状态 ①各气体物质的物质的量浓度 ②气体的总物质的量 ③混合气体的压强 ④混合气体的密度 A.只有①② 只有①④ 只有①③④ ①②③④
 C.(g)+D.(g) 已达到平衡状态 ①混合气体的压强 ②混合气体的密度 ③各气体物质的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 A.②③⑤ ①②③ ②③④⑤ ①③④⑤
C.(g)+D.(g) 已达到平衡状态 ①混合气体的压强 ②混合气体的密度 ③各气体物质的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 A.②③⑤ ①②③ ②③④⑤ ①③④⑤
 C.(气)+D(气)已达到平衡状态的是:( ) A. 混合气体的压强 混合气体的密度 气体的总物质的量 A.的物质的量浓度
C.(气)+D(气)已达到平衡状态的是:( ) A. 混合气体的压强 混合气体的密度 气体的总物质的量 A.的物质的量浓度
 C.(g)+D.(g)已达到平衡状态( ) ①混合气体的压强 ②混合气体的质量 ③各气体物质的物质的量浓度 ④气体的总物质的量⑤混合气体的平均相对分子质量 A.②③⑤ ①②③ ②③④⑤ ①③④⑤
C.(g)+D.(g)已达到平衡状态( ) ①混合气体的压强 ②混合气体的质量 ③各气体物质的物质的量浓度 ④气体的总物质的量⑤混合气体的平均相对分子质量 A.②③⑤ ①②③ ②③④⑤ ①③④⑤
混合气体的总物质的量 B的物质的量浓度
 C.(g)+D.(g)已达到平衡状态( )①混合气体的压强 ②混合气体的密度 ③各气体物质的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量A.②③⑤ ①②③ ②③④⑤ ①③④⑤
C.(g)+D.(g)已达到平衡状态( )①混合气体的压强 ②混合气体的密度 ③各气体物质的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量A.②③⑤ ①②③ ②③④⑤ ①③④⑤
 2C(g)+D.(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是 ( ) A.容器的体积不再发生变化 B.的生成速率和D.的反应速率之比为3∶1 混合气体的密度不随时间变化 B.C.D.的分子个数之比为3∶2∶1
2C(g)+D.(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是 ( ) A.容器的体积不再发生变化 B.的生成速率和D.的反应速率之比为3∶1 混合气体的密度不随时间变化 B.C.D.的分子个数之比为3∶2∶1
 C.(g)+D.(g)已达到平衡状态( ) ①混合气体的压强;②混合气体的密度;③各气体物质的物质的量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量 A.②③⑤ ①②③ ②③④⑤ ①③④⑤
C.(g)+D.(g)已达到平衡状态( ) ①混合气体的压强;②混合气体的密度;③各气体物质的物质的量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量 A.②③⑤ ①②③ ②③④⑤ ①③④⑤
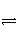
 C.(g)+D.(g)已达到平衡状态的是( ) A.混合气体的密度 混合气体的总物质的量 混合气体的平均相对分子质量 体系的温度不变
C.(g)+D.(g)已达到平衡状态的是( ) A.混合气体的密度 混合气体的总物质的量 混合气体的平均相对分子质量 体系的温度不变
 C.(g)+D.(g)。当下列物理量不再发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强③混合气体总物质的量 ④B物质的量浓度 A. ①和④ ②和③ ②③④ 只有④
C.(g)+D.(g)。当下列物理量不再发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强③混合气体总物质的量 ④B物质的量浓度 A. ①和④ ②和③ ②③④ 只有④
 2C(g)+D(g)已达平衡状态的是( ) A.混合气体的压强 混合气体的总物质的量 混合气体的平均相对分子质量 v(B.)=3V(D.)
2C(g)+D(g)已达平衡状态的是( ) A.混合气体的压强 混合气体的总物质的量 混合气体的平均相对分子质量 v(B.)=3V(D.)