你可能感兴趣的试题
等物质的量浓度的各溶液pH关系为pH(CH3COOH)>pH(H2C2O4)>pH(HCN) a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液不可能呈碱性 向Na2C2O4溶液中滴加足量HCN溶液产生二氧化碳气体 H2C2O4能使酸性高锰酸钾溶液褪色
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
电离平衡常数越小,表示弱电解质的电离能力越弱 电离平衡常数与温度无关 不同浓度的同一弱电解质,其电离平衡常数不同 多元弱酸各步电离平衡常数相互关系为:K1〈K2〈K3
不同浓度的同一弱电解质,其电离平衡常数(K.)不同 电离平衡常数(K.)越小,表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K.1<K.2<K.3 CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小
NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-) 1 mol·L-1HCN溶液与1mol·L-1 NaOH溶液等体积混合后,测得所得溶液显酸性 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) 1mol/L.醋酸溶液加水稀释,所有离子浓度均减小
化学反应速率v 化学平衡常数K. 水的离子积常数Kw 弱酸的电离常数Ka
CH3COONa NaClO Na2CO3 Na3PO4
一定温度下,弱酸的电离常数越大,酸性越强 醋酸的电离常数Ka和醋酸钠的水解常数Kh之间的关系为:Ka·Kh=Kw 溶度积越小,该物质一般越容易在溶液中形成沉淀 合成氨的反应,正反应的平衡常数和逆反应的平衡常数相同。
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式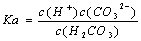 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
各平衡常数的大小与温度有关 若温度升高则各平衡常数一定增大 平衡常数的大小能说明反应(或电离、溶解)进行的程度 平衡常数越大反应(或电离、溶解)程度越大
不同浓度的同一弱电解质,其电离常数(K.)不同 温度越高,化学平衡常数一定越大 平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 化学平衡发生移动,平衡常数必发生变化
平衡常数与温度有关 平衡常数可以反映反应进行程度的大小 平衡常数常有KC和KP两类 平衡常数都没有单位
碳酸的酸性强于氢硫酸 多元弱酸的酸性主要由第一步电离决定 多元弱酸的各步电离之间无影响 向弱酸溶液中加少量NaOH固体,电离常数不变
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度的变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
等物质的量浓度的各溶液pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) amol·L—1HCN溶液与amol·L—1NaOH溶液等体积混合后,所得溶液显碱性(pH>7),则c (OH-)>c(H+),c(Na+)>c(CN-) 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-) +c(CO )
)
HNO2的电离平衡常数是③ HNO2的电离平衡常数是① HCN的电离平衡常数是② HF的电离平衡常数是①
电离度越大,电离平衡常数越大; 浓度越稀,电离度越大,电离平衡常数越大; 在相同的温度下电离度可变,而电离平衡常数不变; 多元弱酸的每一步电离平衡常数是相同的

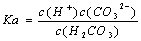 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1 )
)