你可能感兴趣的试题
同主族元素的单质及化合物的化学性质发生递变是由其电子层数的递变引起的 过渡元素包括了大部分金属元素 第4、5、6周期称为长周期 第7周期若填满,可有50种元素
K>Ca>Mg>Al Ca>K>Al>Mg Al>Mg>Ca>K Mg>Al>K>Ca
电子层数逐渐增多 原子半径逐渐减小 最高正价数值逐渐增大 从硅到氯负价从–4→–1
Ca>K>Al>Mg Al>Mg>Ca>K K>Ca>Mg>Al Mg>Al>K>Ca
原子半径:C > Al > Na > K 碱性:NaOH > KOH > Ca(OH)2 > Mg(OH)2 最高正价:Cl > Si > Al > Na 离子半径:O2->F ->Al3+> Mg2+ > Na+
电子层数逐渐增多 原子半径逐渐增大 最高正化合价数值逐渐增大 从Si到Cl,最低负化合价从-4到-1
同时改变两个变量来研究反应速率的变化,能更快得出有关规律 对于同一个化学反应,无论是正反应还是逆反应,其反应的焓变相同 根据11-17号元素最高价氧化物对应水化物的酸碱性递变规律,推出同周期元素的金属性、 非金属性递变规律 从HF、HCl、HBr、HI酸性递增的事实,推出F.、Cl、Br、I.的非金属递增的规律
金属性逐渐增强 原子半径逐渐增大 最高正价数值逐渐减小 从硅到氯负价从-4  -1
-1
卤化银AgF、AgCl、AgBr、AgI都难溶于水 卤化氢的键能按H.-F.、H.-Cl、H.-Br、H.-I.的顺序依次减小 卤化氢的酸性按HF、HCl、HBr、HI的顺序依次减弱 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
烷烃的熔、沸点随着相对分子质量的增大而降低 烷烃分子的含碳量随着碳原子个数增大而减小 相同质量的烷烃完全燃烧消耗氧气的量随着相对分子质量的增大而增大 烷烃的分子通式为CnH2n+2(n≥1)
C.2H4和C.3H6一定属于同系物 淀粉[(C6H10O5)n]与纤维素[(C6H10O5)n]互为同分异构体 同系物之间化学性质相似,物理性质递变 同分异构体之间化学性质相似,物理性质递变
原子半径:C.>Al>Na>K 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 离子半径:O2->F->Al3+>Mg2+>Na+ 最高正价:Cl>Si>Al>F
酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C 碱性:KOH>Mg(OH)2>NaOH ;金属性:K>Mg>Na 稳定性:HF>H2O>NH3 ;还原性: HF < H2O < NH3 离子半径:Na+>Mg2+>Cl—;原子半径:Na>Mg> Cl
酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C 碱性:KOH>Mg(OH)2>NaOH ;金属性:K>Mg>Na 稳定性:HF>H2O>NH3 ;还原性: HF < H2O < NH3 离子半径:Na+>Mg2+>Cl—;原子半径:Na>Mg> Cl
按油分—树脂—地沥青质的顺序递变 固定不变 按地沥青质—树脂—油分的顺序递变 不断减少
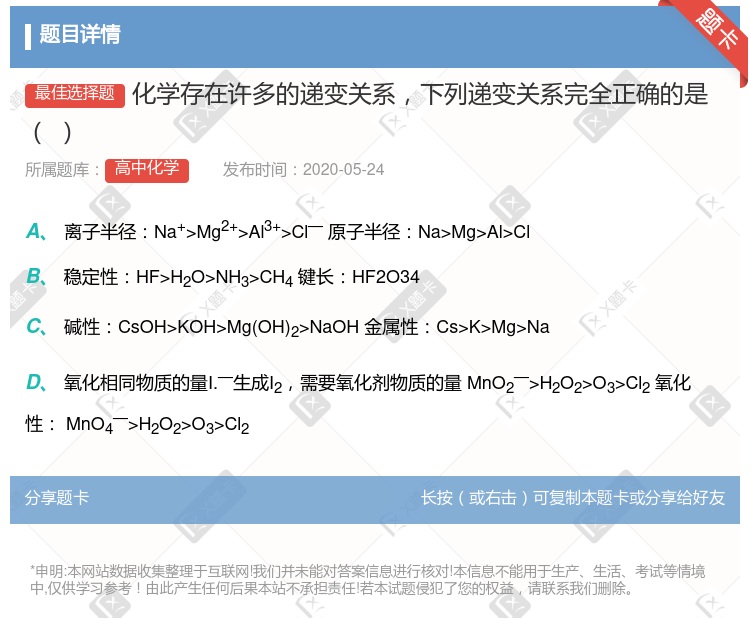
离子半径:Na+>Mg2+>Al3+>Cl— ;原子半径:Na>Mg>Al>Cl 稳定性:HF>H2O>NH3>CH4 ; 还原性: HF < H2O < NH3< CH4 碱性:CsOH>KOH>Mg(OH)2>NaOH ; 金属性:Cs>K>Mg>Na 酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C
原子半径:C.>Al>Na>K 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 离子半径:O2->F.->Al3+>Mg2+>Na+ 最高价:Cl>Si>Al>F.
 -1
-1