你可能感兴趣的试题
缩小体积使压强增大 恒容,充入N2 恒容,充入He 恒压,充入He
加入少量W,逆反应速率增大 平衡后加入X,上述反应的ΔH增大 升高温度,平衡逆向移动 当容器中气体压强不变时,反应达到平衡
加入少量W.,逆反应速率增大 当容器中气体压强不变时,反应达到平衡 升高温度,平衡逆向移动 改变条件,又达新平衡,此时上述反应的平衡常数K.值一定增大
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度不变 保持容器体积不变,充入一定量的Z.,X.的体积分数增大
反应物分子间的碰撞一定能发生化学反应 X(g)+2Y(g)  2Z(g) △H<0,反应达平衡后缩小容器体积,X.浓度变小 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H.<0 反应2A(g)+B.(g)
2Z(g) △H<0,反应达平衡后缩小容器体积,X.浓度变小 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H.<0 反应2A(g)+B.(g) 3C(g)△H>0,在一定体积的密闭容器中达平衡后,加入B.,反应的△H.增大
3C(g)△H>0,在一定体积的密闭容器中达平衡后,加入B.,反应的△H.增大
缩小体积使压强增大 恒容,充入N2 恒容,充入He 恒压,充入He
容器中压强不变 单位时间内消耗了nmolCO2,同时生成了nmol H2O v正(H2)= v逆(H2O) c(CO2) = c(CO)
v(CO2)= v(CO) 容器中总压强不变
容器中混合气体的密度不变 容器中CO的体积分数不变
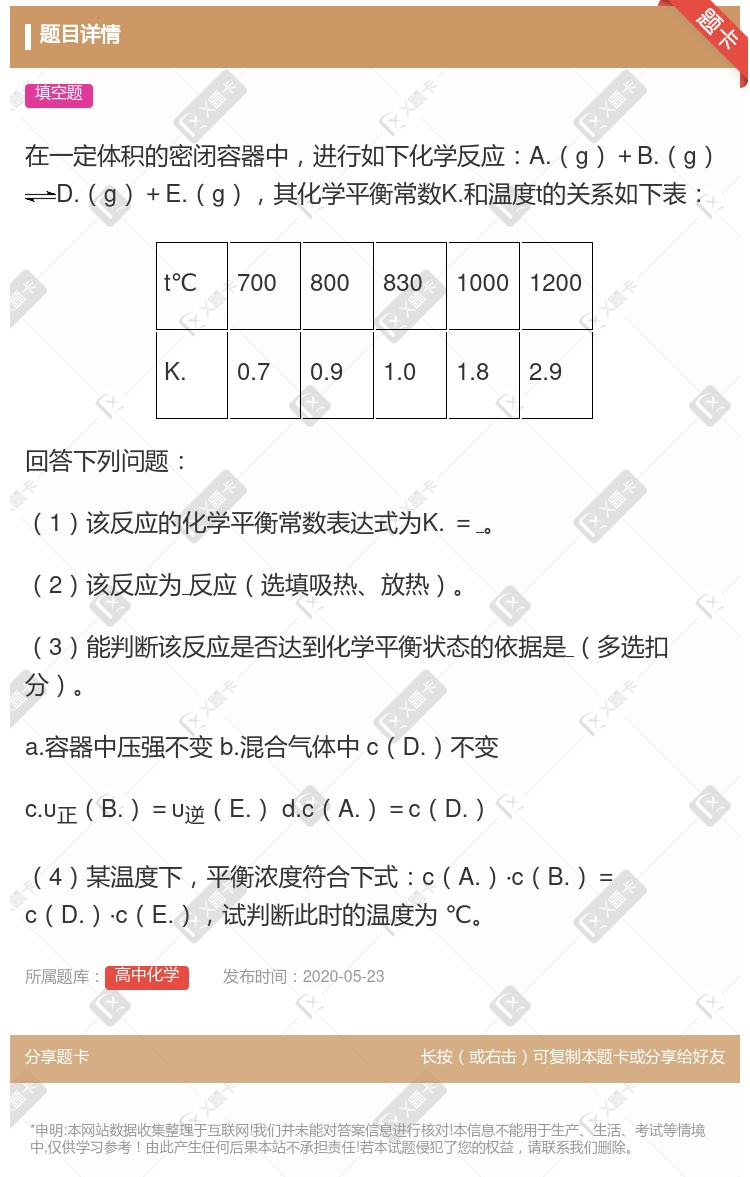
此反应为放热反应 此反应只有达到平衡时,密闭容器中的压强才不会变化 此反应达到1000 ℃时的反应速率比700 ℃时大 该反应的化学平衡常数越大,反应物的转化率越低
该反应的正反应为放热反应,即a<0 当υ正(H2)=υ正(H2O )时,该反应达到化学平衡状态 当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动 当平衡浓度符合c(CO2)·c(H2)=c(CO)·c(H2O)时的温度为830℃
混合气体的颜色不再改变 混合气体的压强不再改变 单位时间内拆开1 mol H—H键,同时生成2 mol H—I键 混合气体的密度不再改变
在容器中加入氩气,反应速率不变 加入少量W.,逆反应速率增大 升高温度,正反应速率增大,逆反应速率减小 将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大
此反应为放热反应 此反应只有达到平衡时,密闭容器中的压强才不会变化 此反应达到1 000 ℃时的反应速率比700 ℃时大 该反应的化学平衡常数越大,反应物的转化率越低
其他条件不变仅将容器的体积缩小一半,反应速率减小 保持体积不变,当混合气体密度不变时,反应达到平衡状态 保持体积不变,充入少量He使体系压强增大,反应速率一定增大 其他条件不变,适当增加C.(s)的质量会使反应速率增大
升高温度,X的体积分数减小 增大压强(缩小容器体积),Z的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变 保持容器体积不变,充入一定量的Z,X的体积分数增大
 2Z(g) △H<0,反应达平衡后缩小容器体积,X.浓度变小 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H.<0 反应2A(g)+B.(g)
2Z(g) △H<0,反应达平衡后缩小容器体积,X.浓度变小 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H.<0 反应2A(g)+B.(g) 3C(g)△H>0,在一定体积的密闭容器中达平衡后,加入B.,反应的△H.增大
3C(g)△H>0,在一定体积的密闭容器中达平衡后,加入B.,反应的△H.增大