你可能感兴趣的试题
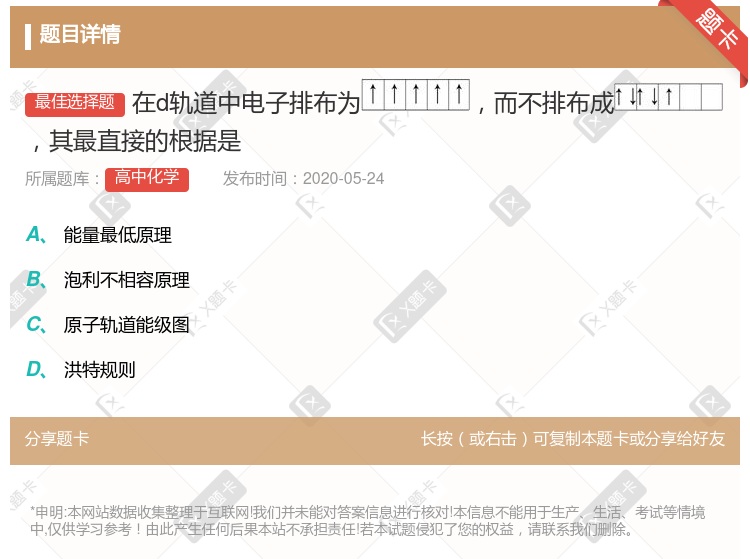
能量最低原理 泡利原理 原子轨道构造原理 洪特规则
含多个电子的原子中,能量高的电子在离核近的区域运动 每个电子层最多容纳的电子数是2n2个 最外层电子数不超过8个(第1层为最外层时,电子数不超过2个) 核外电子是分层排布的,元素的化学性质与原子的最外层电子排布密切相关
能量最低原理 泡利原理 原子轨道构造原理 洪特规则
最外层电子排布为1s2的原子和最外层电子排布为2s2的原子,所对应的两元素一定在同一主族 3p能级上有1个空轨道的原子和4p能级上有1空轨道的原子,所对应的两元素一定在同一主族 最外层电子排布为nsnnpn的原子和最外层电子排布为2s22p6的离子,所对应的两元素一定在同一周期 原子核外M.层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子,所对应的两元素一定在同一周期
2p能级上只有1个空轨道的原子和3p能级上只有1个空轨道的原子 最外层电子排布为3s2的原子和最外层电子排布为4s2的原子 最外层电子排布为ns2的原子和最外层电子排布为ns2np6的原子 2p能级上有2个未成对电子的原子和3p能级上有2个未成对电子的原子
能量最低原理 泡利原理 原子轨道构造原理 洪特规则
3p能级上有2个未成对电子的原子和4p能级上有2个未成对电子的原子 3p能级上只有1个空轨道的原子和4p能级上只有1个空轨道的原子 最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子
能量最低原理 泡利原理 原子轨道构造原理 洪特规则
能量最低原理 泡利原理 原子轨道构造原理 洪特规则
两原子的核外全部都是s电子 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 原子和外M.层上的s、p轨道都充满电子,而d轨道上没有电子的两种原子 两原子N.层上都有1个s电子,一个原子有d电子,另一个原子无d电子