
 A.
A. g·cm-3
g·cm-3  g·cm-3
g·cm-3  g·cm-3
g·cm-3  g·cm-3
g·cm-3
 g· cm-3
g· cm-3  g· cm-3
g· cm-3  g· cm-3
g· cm-3  g· cm-3
g· cm-3 
 A.8∶6∶1B.4∶3∶1 1∶6∶1 1∶3∶1
A.8∶6∶1B.4∶3∶1 1∶6∶1 1∶3∶1
 g/cm3
g/cm3 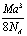 g/cm3
g/cm3  g/cm3
g/cm3  g/cm3
g/cm3
 A.
A.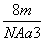 g·cm-3
g·cm-3  g·cm-3
g·cm-3  g·cm-3
g·cm-3  g·cm-3
g·cm-3
 g·cm-3
g·cm-3  g·cm-3
g·cm-3  g·cm-3
g·cm-3  g·cm-3
g·cm-3
 g· cm-3
g· cm-3  g· cm-3
g· cm-3  g· cm-3
g· cm-3  g· cm-3
g· cm-3
 g· cm-3
g· cm-3  g· cm-3
g· cm-3  g· cm-3
g· cm-3  g· cm-3
g· cm-3
 g/cm3
g/cm3  g/cm3
g/cm3  g/cm3
g/cm3  g/cm3
g/cm3