你可能感兴趣的试题
同主族元素从上到下的第一电离能逐渐减小 同周期主族元素从左到右,原子半径逐渐减小 电负性是相对值,所以没有单位 金属元素的电负性较大,非金属元素的电负性较小
是由不同元素原子形成的共价键 共价化合物中必定存在极性键 极性键中电负性大的原子显正电性 共用电子对必然偏向吸引电子能力强的原子一方
B>Al>Be≈Mg B>Be≈Al>Mg B≈Al Be>B>Al>Mg
元素的第一电离能是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的电离能逐渐增大 元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小 元素的性质随着原子序数的增大而呈周期性变化 鲍林的电负性是以氟的电负性为4.0和锂的电负性为1.0作为相对标准得出的
钙元素的电负性的取值范围在0.8与1.2之间 硫化钠的电子式为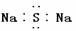 硅元素的电负性的取值范围 在1.5与2.1之间 Al与S.形成的化学键可能为共价键
硅元素的电负性的取值范围 在1.5与2.1之间 Al与S.形成的化学键可能为共价键
元素的原子在分子中吸引电子的能力称为电负性 同周期元素从左到右,电负性随着原子序数增加逐渐变大 同族元素从上到下,随着原子半径的减小而减小 同族元素从上到下,随着原子半径的增大而减小
电负性是人为规定的一个相对数值,不是绝对标准
元素电负性的大小反映了元素对键合电子引力的大小
元素的电负性越大,则元素的非金属性越强
元素的电负性是元素固有的性质,与原子结构无关
ⅠA.元素的电负性从上到下逐渐减小,ⅦA.元素的第一电离能从上到下逐渐减小 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 氢原子中只有一个电子,故氢原子只有一个原子轨道 NaH的存在能支持可将氢元素放在ⅦA.的观点
第一电离能的周期性递变规律是原子半径、化合价、电子排布周期性变化的结果
通常元素的第一电子亲和能为正值,第二电子亲和能为负值
电负性是相对的,所以没有单位
金属元素的电负性较大,非金属元素的电负性较小
原子序数和原子半径大小顺序均为:X元素X.与元素Y.能形成离子化合物 元素Z.最高价氧化物对应水化物具有两性 元素Y.形成的气态氢化物水溶液呈强酸性
第一电离能的大小:Mg>Al。 锗的第一电离能高于碳而电负性低于碳 Ni是元素周期表中第28号元素,第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳 元素的第一电离能:Al
周期表从左到右,元素的电负性逐渐变大 周期表从上到下,元素的电负性逐渐变大 电负性越大,金属性越强 电负性越小,非金属性越强
Se<Te<S<O C<N<O<F P<S<O<F K<Na<Mg<Al
B>Be>Mg B>Mg>Be Be<B<Mg B<Be<Mg
第一电离能、电负性的周期性递变规律是原子核外电子排布周期性变化的结果 电负性的大小也可以作为判断金属性和非金属性强弱的尺度 电负性是相对的,所以没有单位 分析元素的电负性数值可以看出,金属元素的电负性较大,非金属元素的电负性较小
原子半径逐渐减小 电子层数逐渐增多 最高正化合价逐渐增大 元素的电负性逐渐增强
周期表中同周期元素从左到右,元素的电负性逐渐增大 周期表中同主族元素从上到下,元素的电负性逐渐增大 电负性越大,金属性越强 电负性越小,非金属性越强
电负性用来描述不同元素的原子对键合电子吸引力的大小 电负性是以氟为4.0、锂为1.0作为标准的相对值 元素电负性越小,元素非金属性越强 元素电负性越大,元素非金属性越强
O.<S.<Se<Te C.<N.<O.<F. P.<S.<O.<F K.<Na<Mg<Al

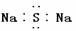 硅元素的电负性的取值范围 在1.5与2.1之间 Al与S.形成的化学键可能为共价键
硅元素的电负性的取值范围 在1.5与2.1之间 Al与S.形成的化学键可能为共价键