你可能感兴趣的试题
将35克NH4Cl溶于适量水中,加15mol/L的NH3·H2O24毫升用水稀释至500ml 将3克NH4Cl溶于适量水中,加15molmol/L的NH3·H2O207ml用水稀释至500ml 将60克NH4Cl溶于适量水中,加15mol/L的NH3·H2O1.4ml用水稀释至500ml 将27克NH4Cl溶于适量水中,加15mol/L的NH3·H2O197ml用水稀释至500ml
M点溶液中水的电离程度比原溶液大 在M.点时,n(OH-)-n(H+)=(a -0.05)mol 随着NaOH的加入,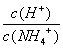 不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
常温下将0.1 mol·L-1 NH4Cl溶液与0.05 mol·L-1 NaOH溶液等体积混合, c (Cl-)> c (Na+)> c(NH4+)> c (OH-)> c (H+) 常温下物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>② 0.1mol·L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A.) 在相同条件下,将足量AgCl加入等体积的①0.01 mol·L-1 KCl②0.1 mol·L-1 KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
NH4+离子浓度由大到小的顺序为② > ④ > ① > ③ NH3·H2O分子浓度由大到小的顺序为② > ③ > ① > ④ 溶液的pH由大到小的顺序为③ > ② > ① > ④ 溶液中的离子总浓度由大到小的顺序为④ > ① > ② > ③
饱和氯水中滴加NaOH至溶液呈中性:c(Na+)═ 2c(ClO﹣)+c(HClO) 100ml 0.2mol/L的NH4Cl溶液和200ml 0.1mol/L的NH4Cl溶液所含有的n(NH4+)相同 pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH﹣)≥c(H+) 常温下,pH=4.75、浓度均为0.1mol/L的CH3COOH、CH3COONa混合溶液: c(CH3COO﹣)+c(OH﹣)<c(CH3COOH)+c(H+)
1 mol N4分子的质量是56 g 标况下,NA个 H2O分子含有3NA个原子 常温下,1 mo/L 的NH4Cl 溶液中NH4+的浓度小于1 mol/L 高温__,催化剂条件下,28 g N2分子与6 g H2充分反应可生成34 g NH3
在常温下氮气比氧气和氯气稳定 氮、氧和氯的单质常温下为气体 氮、氧和氯都是双原子分子 氮气、氧气和氯气的密度不同
常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c(NH4+)>c(H+)=c(OH-) 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大
常温下将0.1 mol·L.-1NH4Cl溶液与0.05 mol·L.-1NaOH溶液等体积混合,c(Cl-) > c(Na+) > c(NH4+) > c (OH-) > c (H+) 常温下,物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>② 0.1mol·L.-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A.) 在相同条件下,将足量AgCl加入等体积的①0.01 mol•L-1AgNO3溶液②0.1 mol•L-1KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 常温下,将pH =10的氨水稀释后,溶液中所有离子浓度都减小 常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+)
常温下,在pH<7的酸性溶液中,不可能存在NH3・H2O 常温下.在pH=7的NH4Cl和NH3・H2O的混合液中。c(NH4+)=(Cl-) 将等物质的量的NH4Cl和NH3・H2O溶于水配成溶液.则溶液中c(NH4+)<(Cl-) 在0.1moL/L.的K2S溶液中:c(K+)=c(S2-)+c(HS-)+c(H2S)
pH相同的盐酸与氯化铵溶液中,水的电离程度相同 加入少量Mg(OH)2固体,c(NH4+)减小 溶液加水稀释时, 逐渐增大 加入等体积0. 05 mol • L-1的NaOH溶液时: c(Na+) =c(Cl-) >c(NH4+)>c(OH-)>c( H+)
逐渐增大 加入等体积0. 05 mol • L-1的NaOH溶液时: c(Na+) =c(Cl-) >c(NH4+)>c(OH-)>c( H+)

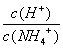 不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
 逐渐增大 加入等体积0. 05 mol • L-1的NaOH溶液时: c(Na+) =c(Cl-) >c(NH4+)>c(OH-)>c( H+)
逐渐增大 加入等体积0. 05 mol • L-1的NaOH溶液时: c(Na+) =c(Cl-) >c(NH4+)>c(OH-)>c( H+)