你可能感兴趣的试题
阳极反应为Fe-2e- = Fe2+ 过程中有Fe(OH)3沉淀生成 电路中每转移12mol电子,最多有1mol Cr2O72-被还原 如果石墨做阴阳极,电解过程不变
阳极反应为Fe-2e-==Fe2+ 电解过程中溶液pH不会变化 过程中有Fe(OH)3沉淀生成 电路中每转移12mol电子,最多有1 mol Cr2O72-被还原
阳极反应为Fe - 2e- = Fe2+ 过程中有Fe(OH)3沉淀生成 电路中每转移12mol电子,最多有1mol Cr2O72-被还原 如果石墨做阴阳极,电解过程不变
A.为电源正极 阴极区附近溶液pH升高 阳极区溶液中发生的氧化还原反应为: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 若不考虑气体的溶解,当收集到H213.44L.时,有0.1 mol Cr2O72-被还原
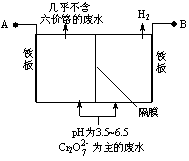
阳极反应为Fe-2e-═Fe2+
在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑
在阳极室,PH增大会有Fe(OH)3沉淀生成
电路中每转移12 mol电子,最多有1 mol Cr2O72-被氧化
阳极材料也可以是Cu 阴极每产生3molH2,则有1mol Cr2O72-被还原 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀
阳极反应为Fe-2e-=Fe2+ 电解过程中溶液pH不会变化 过程中有Fe(OH)3沉淀生成 电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原
A.为电源正极 阴极区附近溶液pH升高 阳极区溶液中发生的氧化还原反应为: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 若不考虑气体的溶解,当收集到H213.44L.时,有0.1 mol Cr2O72-被还原
还原法处理工业废水是投加还原剂或电解的方法使废水中的污染物质经还原反应转变为无害或少害的新物质 处理含铬废水是利用还原剂将三价铬转化为六价铬 处理含铬废水时还原反应pH值宜控制在7~9 电解法处理含铬废水,六价铬在阳极还原
采用离子交换法处理含铬废水出水水质好,可循环利用 采用电解法不需投加化学药剂,处理效果稳定,能耗低 铁屑内电解法对含铬废水有较好的处理效果 采用化学法向含铬废水中投加碱性物质,使其产生金属氢氧化物沉淀去除
电解槽中H+向阳极移动 阳极的电极反应式是:Fe-3e-= Fe3+ 电解一段时间后,阴极区溶液的pH升高 阳极的铁板可用石墨代替