
 2AB3(g)的ΔH>0 图②表示压强对可逆反应2A(g)+2B(g)
2AB3(g)的ΔH>0 图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D.(s)的影响,甲的压强大 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右
3C(g)+D.(s)的影响,甲的压强大 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右
 2AB3 (g)的△H>0 图②可表示压强对可逆反应2A(g) +2B(g)
2AB3 (g)的△H>0 图②可表示压强对可逆反应2A(g) +2B(g)  3C (g) +D.(s)的影响,乙的压强大 图③可表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
3C (g) +D.(s)的影响,乙的压强大 图③可表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
 3C(g)+D(g)的影响,且甲的压强大 图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 图4表示在2L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
3C(g)+D(g)的影响,且甲的压强大 图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 图4表示在2L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
 2AB3(g),正反应是吸热反应 图②表示压强对反应2A(g)+2B(g)
2AB3(g),正反应是吸热反应 图②表示压强对反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 图③可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 根据图④可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在 4~5之间即可
3C(g)+D(s)的影响,乙的压强大 图③可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 根据图④可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在 4~5之间即可
 2AB3(g)”的ΔH >0 图②表示压强对可逆反应2A(g)+2B(g)
2AB3(g)”的ΔH >0 图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
3C(g)+D(s)的影响,乙的压强大 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
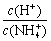 随HCl溶液的体积变化关系 图乙表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应 2NO2(g)
随HCl溶液的体积变化关系 图乙表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应 2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH.>0 图丙表示0.100 0 mol·L−1 NaOH溶液滴定20.00 mL 0.100 0 mol·L−1醋酸溶液的滴定曲线 根据图丁,若要除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO至pH在7左右
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH.>0 图丙表示0.100 0 mol·L−1 NaOH溶液滴定20.00 mL 0.100 0 mol·L−1醋酸溶液的滴定曲线 根据图丁,若要除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO至pH在7左右
 3Z(g)+W(s)的影响,甲使用催化剂 图②表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 图③表示在1L. 1 mol·L-1FeBr2溶液中通人C.12时Br-的量的变化 图④表示一定浓度NaHCO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
3Z(g)+W(s)的影响,甲使用催化剂 图②表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 图③表示在1L. 1 mol·L-1FeBr2溶液中通人C.12时Br-的量的变化 图④表示一定浓度NaHCO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
 2AB3(g),正反应是吸热反应 图②表示压强对反应2A(g)+2B(g)
2AB3(g),正反应是吸热反应 图②表示压强对反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 图③可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 根据图④可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在 4~5之间即可
3C(g)+D(s)的影响,乙的压强大 图③可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 根据图④可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH在 4~5之间即可
 2AB3(g)”的ΔH.>0 图②表示压强对可逆反应2A(g)+2B(g)
2AB3(g)”的ΔH.>0 图②表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强大 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
3C(g)+D(s)的影响,乙的压强大 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
 2AB3(g)正反应是吸热反应 图②表示压强对可逆反应2A(g)+2B(g)
2AB3(g)正反应是吸热反应 图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 根据图④溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,至pH在4左右。
3C(g)+D(s)的影响,乙的压强大 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 根据图④溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,至pH在4左右。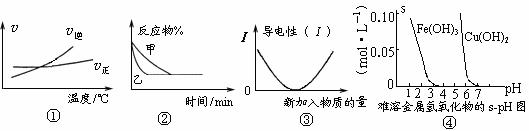

 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0