你可能感兴趣的试题
图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用 a极上发生氧化反应,产生的气体X.是H2 图2溶液中阳离子从B.极流向A.极 c极上发生的电极反应是O2+2H2O+4e—=4OH—
转移0.1mol电子时,a电极产生1.12LH2(标准状况) b电极上发生的电极反应是: 2H2O+2e-=H2↑+2OH- c电极上进行还原反应,B.电池中的H+可以通过隔膜进入A.池 d电极上发生的电极反应是:O2+4H++4e-=2H2O
当有0.1mol电子转移时,a极产生1.12L O2(标准状况下) b极上发生的电极反应是:4H2O + 4e- = 2H2↑+ 4OH- d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O c极上发生还原反应,B.中的H+可以通过隔膜进入A.室
当有0.1 mol电子转移时,a极产生1.12 L O2(标况) b极上发生的电极反应是:2H + 2e- = H2↑ d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O c极上进行还原反应,B.中的H.+可以通过隔膜进入A.
+ 2e- = H2↑ d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O c极上进行还原反应,B.中的H.+可以通过隔膜进入A.
该电池工作时电能转化为化学能 该电池中电极a是正极 外电路中电子由电极a通过导线流向电极b 该电池的总反应:H2+O2=H2O
B.区的OH-通过隔膜向a电极移动,A区pH增大 图中右管中的OH-通过隔膜向c电极移动,d电极上发生还原反应 c是正极,电极上的电极反应为:  当有1mol电子转移时,b电极产生气体Y.的体积为11.2L
当有1mol电子转移时,b电极产生气体Y.的体积为11.2L
该电池工作时电能转化为化学能 该电池中电极b是负极 外电路中电子由电极b通过导线流向电极a 该电池是绿色环保电池
当有0.1mol电子转移时,a极产生1.12L O2(标准状况下) b极上发生的电极反应是:4H2O + 4e- = 2H2↑+ 4OH- d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O c极上进行还原反应,B.中的H+可以通过隔膜进入A.
当有0.1mol电子转移时,a 极产生1.12L气体 b极上发生的电极反应是:4H2O+4e-=2H2↑+4OH– c 极上发生还原反应,B.中的H+ 可以通过隔膜进入A. d 极上发生的电极反应是:O2+4H++4e-=2H2O
当有0.1mol电子转移时,a极产生1.12L O2(标准状况下) b极上发生的电极反应是:4H2O + 4e- = 2H2↑+ 4OH- d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O c极上进行还原反应,B.中的H+可以通过隔膜进入A. 
当有0.1 mol电子转移时,a极产生1.12L. O2(标准状况下) b极上发生的电极反应是:4H2O+4e-==2H2↑+4OH- c极上发生的电极反应是:O2+4H++4e-==2H2O d极上进行还原反应,产生的H.+可以通过隔膜进入A.
a电极是负极 b电极的电极反应为: 4OH--4 e-=2H2O +O2 电池工作时,电子由正极通过外电路流向负极 氢氧燃料电池是一种具有应用前景的绿色电源
当有0.1 mol电子转移时,a极产生 0.56L. O2(标准状况下) 左端装置中化学能转化为电能,右端装置中电能转化为化学能 d极上发生的电极反应是:O2 + 4H+ + 4e- 2H2O c极上进行还原反应,右端装置B.中的H+可以通过隔膜进入A. 
a电极是负极 b电极上发生氧化反应 氢氧燃料电池是一种具有应用前景的绿色电源 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在 电池内的新型发电装置
固体氧化物燃料电池, 碱性氢氧化物燃料电池, 质子交换膜燃料电池, 熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( ) 

当有0.1mol电子转移时,a电极产生1.12LH2(标准状况下) b电极上发生的电极反应是: 4H2O+4e-=2H2↑+4OH- c电极上进行的是氧化反应,B池中的H+可以通过隔膜进入A.池 d电极上发生的电极反应是: O2+4H++4e-=2H2O 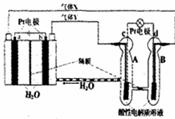
该电池工作时电能转化为化学能 有1mol电子转移时,反应的氧气为5.6L 外电路中电流由电极b通过导线流向电极a 电极b的反应为:O2+4e-+H2O=4OH-
图甲把化学能转化为电能,图乙把电能转化为化学能,水得到了循环使用 当有0.1 mol电子转移时,a极产生0.56 L O2(标准状况下) c极上发生的电极反应是O2+4H++4e-===2H2O 图乙中电子从c极流向d极,提供电能
转移0.1mol电子时,a电极产生1.12LH2(标准状况) b电极上发生的电极反应是: 2H2O+2e-=H2↑+2OH- c电极上进行还原反应,B.电池中的H+可以通过隔膜进入A.池 d电极上发生的电极反应是:O2+4H++4e-=2H2O
当有0.1mol电子转移时,a电极产生0.56L气体(标准状况下) b电极上发生的电极反应是: 4H2O+4e-=2H2↑+4OH- c电极上进行还原反应,B.电池中的H+可以通过隔膜进入A.池 d电极上发生的电极反应是:O2+4H++4e-=2H2O

 + 2e- = H2↑ d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O c极上进行还原反应,B.中的H.+可以通过隔膜进入A.
+ 2e- = H2↑ d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O c极上进行还原反应,B.中的H.+可以通过隔膜进入A.
 当有1mol电子转移时,b电极产生气体Y.的体积为11.2L
当有1mol电子转移时,b电极产生气体Y.的体积为11.2L





