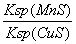你可能感兴趣的试题
该反应显示硫酸具有酸性 NH4CuS03中铜元素全部被氧化 刺激性气味的气体是氨气 反应中硫酸作氧化剂
CuS 23 CuS >Cu(OH)2>CuCO3 Cu(OH)2>CuCO3>CuS Cu(OH)23
CuS 23 CuS >Cu(OH)2>CuCO3 Cu(OH)2>CuCO3>CuS Cu(OH)23
该反应达到平衡时,c(Cu2+)=c(Mn2+) CuS的溶解度比MnS的溶解度小 往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大  该反应平衡常数K=
该反应平衡常数K=
CuSO4+2NaOH====Cu(OH)2↓+Na2SO4 CuS04+NaOH====Cu(OH)2+↓+Na2SO4 CuSO4+2NaOH====Cu(OH)2+Na2SO4↓ CuSO4+2NaOH====CuOH+Na2SO4
Cu(OH)23 CuS 23 CuCO32CuCO3< CuS < Cu(OH)2
相同温度下,CuS在水中的溶解度比MnS小 CuS和MnS一定都溶于强酸 反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+ K=7.5×1021 在浓度均为0.01mol·L-1Cu2+和Mn2+混合溶液中,通入H2S只有MnS沉淀
Cu(OH)2>CuCO3>CuS CuS >Cu(OH)2>CuCO3 CuS 23 Cu(OH)23
该反应达到平衡时c(Cu2+)=c(Mn2+) CuS的溶解度比MnS的溶解度小 往平衡体系中加入少量Cu(NO3)2(s)后,c( Mn2 +)变大 该反应平衡常数表达式:K=
CuS 23 CuS >Cu(OH)2>CuCO3 Cu(OH)2>CuCO3>CuS Cu(OH)23
CuS 23 CuS >Cu(OH)2>CuCO3 Cu(OH)2>CuCO3>CuS Cu(OH)23
该反应达到平衡时c(Cu2+)=c(Mn2+) CuS的溶解度比MnS的溶解度小 往平衡体系中加入少量Cu(NO3)2(s)后,c( Mn2 +)变大 该反应平衡常数表达式:K=
向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L 因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生 除去工业废水中的Cu2+可以选用FeS作沉淀剂
MnS使用量越大,废水中的Cu2+的去除率越高 该反应可将工业废水中的Cu2+沉淀完全 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 该反应的平衡常数K.=2.0×1023
该反应达平衡时c(Mn2+)=c(Cu2+) MnS的Ksp比CuS的Ksp大 往平衡体系中加人少量CuSO4固体后,c(Mn2+)变大 该反应的平衡常数K=
CuS23 CuS>Cu(OH)2>CuCO3 Cu(OH)2>CuCO3>CuS Cu(OH)23
该反应达到平衡时c(Cu2+)=c(Mn2+) CuS的溶解度比MnS.的溶解度小 往平衡体系中加入少量Cu(NO3)2(s)后,c( Mn2 +)变大 该反应平衡常数表达式:K=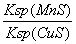
Cu(OH)2>CuCO3>CuS CuS>Cu(OH)2>CuCO3 CuS23 Cu(OH)23

 该反应平衡常数K=
该反应平衡常数K=