你可能感兴趣的试题
溶液中,SO42-朝Y.极移动 若两电极分别为铁和碳棒,则X.为碳棒,Y.为铁 X.极上发生的是还原反应,Y.极上发生的是氧化反应 若两电极都是金属,则它们的活动性顺序为X.>Y.
外电路的电流方向为:X.→外电路→Y. 若两电极分别为铁和碳棒,则X.为碳棒,Y.为铁 X.极上发生的是还原反应,Y.极上发生的是氧化反应 若两电极都是金属,则它们的活动性顺序为X.>Y.
电子从锌电极通过电流计流向铜电极 盐桥中的阴离子向硫酸铜溶液中迁移 锌电极发生还原反应,铜电极发生氧化反应 铜电极上发生的电极反应为2H++2e-===H2↑ 
常用玻璃电极作为测定pH的指示电极 玻璃电极的膜电位与温度无关 玻璃电极的电位与参比电极无关 玻璃电极的电位取决于内参比电极电位
铁以铁蛋白的形式储藏 铁储藏在骨骼中 铁参与体内氧的运输 铁容易从尿中排泄
电子从铜电极通过电流计流向锌电极 盐桥中的阳离子向硫酸铜溶液中迁移 锌电极发生还原反应,铜电极发生氧化反应 铜电极上发生的电极反应是

开关K.置于N.处,则铁电极的电极反应式为:Fe-2e-=Fe2+ 开关K.置于N.处,可以减缓铁的腐蚀 开关K.置于M.处,则铁电极的电极反应式为: 2Cl--2e-=Cl2↑ 开关K.置于M.处,电子从碳棒经开关K.流向铁棒
电极反应是腐蚀的基础 电极与电极反应密不可分 电极反应一定会造成电极的腐蚀 电极由电子型导体与离型导体构成
阳极处,电极电位最正的物质先反应 阴极处,电极电位最正的物质先反应 阴极处,电极电位最负的物质先反应 上述说法都不正确
a电极一定是铁,电解液c可以是CuCl2溶液 电解一段时间,b电极附近pH升高 溶液中的阴离子向a电极移动 在加入苯之前应将电解液c加热煮沸 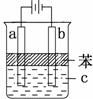
石墨电极作负极 铁片上的反应:Fe - 2e- = Fe2+ 铁电极附近溶液中氢离子浓度增大 电子由石墨电极通过导线流向铁电极
铁是地壳中含量最多的金属元素 铁在空气中燃烧生成四氧化三铁 纯净的生铁属于金属单质 铁桶不能用来配制农药波尔多液
外电路的电流方向为:X→外电路→Y 若两电极分别为铁和碳棒,则X.为碳棒,Y.为铁 X.极上发生的是还原反应,Y.极上发生的是氧化反应 若两电极都是金属,则它们的活动性顺序为X>Y 
一般用来控制搭铁端 一般用来控制供电端 当发射极相对于基极和集电极为正电势时,NPN三极管导通 基极相对于发射极和集电极为正电势时,NPN三极管才可正常工作
电子从锌电极通过检流计流向铜电极 盐桥中的阴离子向硫酸铜溶液中迁移 锌电极发生还原反应,铜电极发生氧化反应 铜电极上发生的电极反应是 
同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-===Fe(OH)2 用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-===H2↑ 装置Ⅰ通电10分钟后铁电极周围溶液pH降低
电子从铜电极通过检流计流向锌电极 盐桥中的阳离子向硫酸铜溶液中迁移 锌电极发生还原反应,铜电极发生氧化反应 铜电极上发生的电极反应是2H++2e-===H2↑ 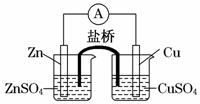
银电极是负极 铜电极上发生的反应为Cu-2e-=Cu2+ 外电路中的电子是从银电极流向铜电极。 该装置能将电能转化为化学能
该装置一定是原电池 石墨电极上可能发生:2H2O-4e-=4H++O2↑ 石墨电极发生还原反应 铁电极一定与电源正极相连







