你可能感兴趣的试题
原电池是将化学能转化为电能的装置 构成原电池的正极和负极必须是两种不同的金属 原电池放电时,电子由正极流向负极 原电池放电时,电流是从负极流向正极
电子从锌片经导线流向铜片 H+向负极移动 一段时间后,铜片质量减轻 锌片发生还原反应
电子通过盐桥从乙池流向甲池 铜导线替换盐桥,原电池仍继续工作 开始时,银片上发生的反应是:Ag-e-=Ag+ 将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
氢离子在负极得电子 锌为负极,发生氧化反应 铜为负极,铜片上有气泡产生 电子从铜极流向锌极
铜棒为负极 锌棒发生还原反应 锌棒质量减轻 电子从铜棒经外电路流向锌棒 
电子从锌电极通过电流计流向铜电极 盐桥的作用是让电子通过构成闭合回路 锌电极质量增重,铜电极质量减轻 盐桥可以用铜导线代替
右图所示原电池中,Cu为正极 右图所示原电池中,开关闭合时,化学能主要转变为电能; 断开时,化学能主要转变为热能 在原电池中,负极上发生氧化反应,正极上发生还原反应 在原电池中,电子从负极经过电解质溶液流向正极
Zn为负极,Cu为正极 正极反应为 Zn﹣2e﹣═Zn2+ 负极反应为Cu﹣2e﹣═Cu2+ 该装置能将电能转化为化学能
构成原电池时Cu极反应为:Cu—2e-=Cu2+ 构成电解池时Cu极质量可能减少也可能增加 构成电解池时Fe极质量一定减少 构成的原电池或电解池工作后就可能产生大量气体 
构成原电池时b极反应为Cu-2e-=Cu2+ 构成电解池时a极质量一定减少 构成电解池时b极质量可能减少也可能增加 构成的原电池或电解池工作后可能产生大量气体
Al为电池的负极,电极反应式为Al-3e-+4OH-===AlO +2H2O 原电池工作过程中,电解质溶液的pH减小 原电池工作一段时间,两极的质量均减小 原电池工作过程中,AlO
+2H2O 原电池工作过程中,电解质溶液的pH减小 原电池工作一段时间,两极的质量均减小 原电池工作过程中,AlO 移向AgO/Ag电极
移向AgO/Ag电极
原电池是将电能转化为化学能的装置 原电池中电子流出的—-榜沩负极,发生还原反应 原电池中阳离子向负极移动 原电池外电路中电流由正极流向负极
化学电池如氢氧燃料电池、锌锰电池、铅蓄电池等都不会造成环境污染 任何化学反应都能设计成原电池 原电池反应中电子总是由负极流出,流入正极 原电池负极被还原
该原电池中,铜为正极 该原电池中,电子由铜片经过导线流入锌片 该原电池工作一段时间后,溶液的酸性减弱 该原电池工作一段时间后,锌片质量减小
原电池是将电能能转化为化学能的装置 原电池负极发生氧化反应 原电池中,阳离子向负极移动 原电池电子流出的一极为正极
构成原电池时b极反应为Cu-2e-=Cu2+ 构成电解池时a极质量一定减少 构成电解池时b极质量可能减少也可能增加 构成的原电池或电解池工作后可能产生大量气体
原电池是利用化学反应产生电流的装置 原电池可以把化学能转变为电能 原电池的负极发生氧化反应 原电池的正极是流出电子的一极
构成原电池时b极反应为Cu-2e-=Cu2+ 构成电解池时a极质量一定减少 构成电解池时b极质量可能减少也可能增加 构成的原电池或电解池工作后可能产生大量气体 
铜电极上的反应为Cu-2e-==Cu2+ 放电时溶液中的阳离子向锌片移动 电池正极发生氧化反应 该电池的负极材料是锌片 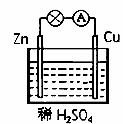
锌片是负极 两个铜片上都发生氧化反应 石墨是阴极 两个番茄都形成原电池




 +2H2O 原电池工作过程中,电解质溶液的pH减小 原电池工作一段时间,两极的质量均减小 原电池工作过程中,AlO
+2H2O 原电池工作过程中,电解质溶液的pH减小 原电池工作一段时间,两极的质量均减小 原电池工作过程中,AlO 移向AgO/Ag电极
移向AgO/Ag电极

