
 )>c(HCO
)>c(HCO )>c(NH2COO-)>c(CO
)>c(NH2COO-)>c(CO ) 不同pH的溶液中存在关系:c(NH
) 不同pH的溶液中存在关系:c(NH )+c(H+)=2c(CO
)+c(H+)=2c(CO )+c(HCO
)+c(HCO )+ c(NH2COO-)+c(OH-) 随着CO2的通入,
)+ c(NH2COO-)+c(OH-) 随着CO2的通入, 不断增大 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
不断增大 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
 不断增大
不断增大
 不断增大 在溶液pH不断降低的过程中,有含NH2COO﹣的中间产物生成
不断增大 在溶液pH不断降低的过程中,有含NH2COO﹣的中间产物生成
 )>c(HCO
)>c(HCO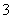 )>c(NH2COO-)>c(CO
)>c(NH2COO-)>c(CO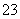 ) 不同pH的溶液中存在关系:c(NH
) 不同pH的溶液中存在关系:c(NH )+c(H+)=2c(CO
)+c(H+)=2c(CO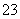 )+c(HCO
)+c(HCO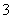 )+c(NH2COO-)+c(OH-) 随着CO2的通入,
)+c(NH2COO-)+c(OH-) 随着CO2的通入, 不断增大 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
不断增大 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
 b—c段反应的离子方程式是:2AlO2-+ 3H2O+ CO2=2Al(OH)3↓+ CO32- a—b段与c—d段所发生的反应相同 d—e段沉淀的减少是由于碳酸钡固体的消失所致
b—c段反应的离子方程式是:2AlO2-+ 3H2O+ CO2=2Al(OH)3↓+ CO32- a—b段与c—d段所发生的反应相同 d—e段沉淀的减少是由于碳酸钡固体的消失所致