
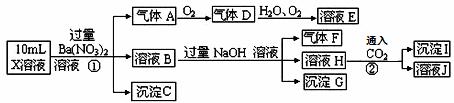
 下列说法正确的是 A.气体A.是NO2 X.中肯定存在Fe2+、A.13+、NH4+、SO42― 溶液E.和气体F.不能发生化学反应 X.中不能确定的离子是A.13+和C.1―
下列说法正确的是 A.气体A.是NO2 X.中肯定存在Fe2+、A.13+、NH4+、SO42― 溶液E.和气体F.不能发生化学反应 X.中不能确定的离子是A.13+和C.1―
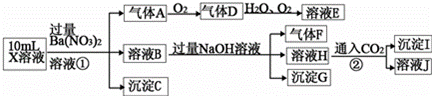 A.X.中肯定存在Fe2+、A.13+、NH4+、SO42ˉ X.中不能确定的离子是A.13+和 1ˉ C.溶液E.和气体F.能发生化学反应 气体A.是NO
A.X.中肯定存在Fe2+、A.13+、NH4+、SO42ˉ X.中不能确定的离子是A.13+和 1ˉ C.溶液E.和气体F.能发生化学反应 气体A.是NO
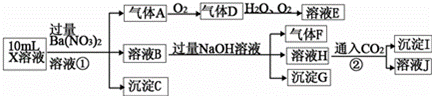 A.X.中肯定存在Fe2+、A.13+、NH4+、SO42ˉ X.中不能确定的离子是A.13+和 1ˉ C.溶液E.和气体F.能发生化学反应 气体A.是NO
A.X.中肯定存在Fe2+、A.13+、NH4+、SO42ˉ X.中不能确定的离子是A.13+和 1ˉ C.溶液E.和气体F.能发生化学反应 气体A.是NO
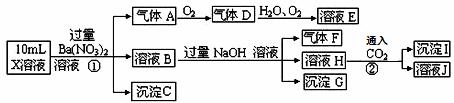 下列说法正确的是( ) A.X.中肯定存在Fe2+、NH4+、SO42— 溶液E.和气体F.不能发生化学反应 X.中肯定不存在CO32—、SO32—、C.1— 沉淀I.是A.1(OH)3
下列说法正确的是( ) A.X.中肯定存在Fe2+、NH4+、SO42— 溶液E.和气体F.不能发生化学反应 X.中肯定不存在CO32—、SO32—、C.1— 沉淀I.是A.1(OH)3
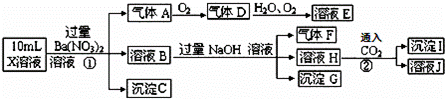 A.气体A.是NO2 X.中肯定存在Fe2+、A.13+、NH4+、SO42﹣ 溶液E.和气体F.不能发生化学反应 X.中不能确定的离子是A.13+和C.1﹣
A.气体A.是NO2 X.中肯定存在Fe2+、A.13+、NH4+、SO42﹣ 溶液E.和气体F.不能发生化学反应 X.中不能确定的离子是A.13+和C.1﹣
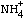 、SO42- X.中不能确定是否存在的离子是Al3+和Cl- 溶液E.和气体F.发生反应,生成物为盐类 气体A.是NO
、SO42- X.中不能确定是否存在的离子是Al3+和Cl- 溶液E.和气体F.发生反应,生成物为盐类 气体A.是NO
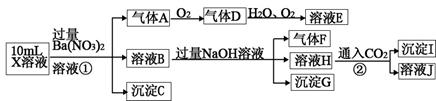 A.气体A.是NO X.中肯定存在Fe2+、A.13+、NH4+、SO42ˉ 溶液E.和气体F.能发生化学反应 X.中不能确定的离子是A.13+和C.1ˉ
A.气体A.是NO X.中肯定存在Fe2+、A.13+、NH4+、SO42ˉ 溶液E.和气体F.能发生化学反应 X.中不能确定的离子是A.13+和C.1ˉ