你可能感兴趣的试题
-1940kJ·mol-1 1940kJ·mol-1 -485kJ·mol-1 485kJ·mol-1
酸和碱发生中和反应生成水,这时的反应热叫中和热 燃烧热或中和热是反应热的种类之一 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ
当∆H﹤0时,表示该反应为吸热反应 已知 (s)+ O2(g)=CO(g) △H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g) △H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
当△H.为“一”时,表示该反应为吸热反应 已知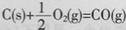 的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
当∆H为“-”时,表示该反应为吸热反应 已知 (s)+ O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
10 L 0.05 mol•L﹣1Ba(OH)2溶液与20 L 0.05 mol•L﹣1 HNO3反应时的反应热是中和热
1 mol HCl气体通入1 L 0.01 mol•L﹣1 NaOH溶液中反应时的反应热是中和热
1 mol HClO与2 mol NaOH溶液反应时的反应热也可能是中和热
只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热
当△H.<0时,表示该反应为吸热反应 C.(s)+0.5O2(g)= CO(g)的反应热110.5kJ·mol—1,知碳燃烧热为110.5 kJ·mol—1 反应热的大小与反应物所具有的能量和生成物所具有的能量无关 l molNaOH分别和l molCH3COOH、1molHNO3反应放出的热量: CH3COOH<HNO3
当ΔH.为“-”时,表示该反应为吸热反应 已知 (s)+ O2(g)===CO(g) ΔH.=—110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1 C.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
O2(g)===CO(g) ΔH.=—110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1 C.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
反应热和焓变的单位都是kJ 如果反应是在恒温恒压条件下进行的,此时的反应热与焓变相等 如果反应是在恒温恒容条件下进行的,此时的反应热与焓变相等 任何化学反应的反应热均可通过实验直接测定
当∆H为“-”时,表示该反应为吸热反应 已知 (s)+ O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
当ΔH.为“-”时,表示该反应为吸热反应 已知 (s)+ O2(g)===CO(g) ΔH.=110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1 C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
O2(g)===CO(g) ΔH.=110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1 C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
放热反应在常温下均能自发进行 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol 反应热的大小与反应物和生成物的键能无关 含1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应,放出的热量相等
当∆H为“-”时,表示该反应为吸热反应 已知 (s)+ O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
碳的燃烧热为110.5 kJ/mol ①的反应热为221 kJ/mol 稀醋酸与稀NaOH溶液反应生成1mol H2O时对应的反应热为-57.3 kJ/mol 稀盐酸与稀NaOH溶液反应生成1mol H2O时对应的反应热为-57.3 kJ/mol

 O2(g)=CO(g) △H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g) △H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
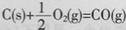 的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
 O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
 O2(g)===CO(g) ΔH.=—110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1 C.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
O2(g)===CO(g) ΔH.=—110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1 C.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
 O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
 O2(g)===CO(g) ΔH.=110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1 C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
O2(g)===CO(g) ΔH.=110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1 C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
 O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关