你可能感兴趣的试题
摩尔是化学上常用的一个物理量 用托盘天平称取25.20 gNaCl 配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 某物质含有6.02×1023个微粒,含有这个数目微粒的物质不一定是1 mol
常温下,将pH=2的盐酸和pH=12的氨水等体积混合: c(NH.4+)>c(Cl-)> c(OH-)>c(H+) 0.1mol·L-1 Na2CO3溶液:2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) 相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2∶1 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中, c(NH4+)的大小关系: ①>②>③
pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2:三种溶液中NH4+的浓度:②>③>① 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N.前>N后
物质的量浓度相等的 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的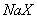 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 
0.1mol·L—1 Na2CO3溶液:[OH—]=[HCO3—] + [H+] +[H2CO3] 0.1mol·L—1 NH4Cl溶液:[NH4+]=[Cl—] 向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液: [Na+]>[CH3COO—]>[H+]>[OH—] 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液: [Na+]=[NO3—]
CaCl2 CH3COONa (NH4)2SO4 K3PO4
0.1 mol·L.-1 Na2CO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+2c(CO32—) 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 将0.2 mol·L.-1 NaA溶液和0.1 mol·L.-1盐酸溶液等体积混合所得碱性溶液中: c(Na+)+c(H+)=c(A-)+c(Cl-) pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
等体积等物质的量浓度NaF 溶液与HF混合:2c(Na+)=c(F)+c(HF) 0.1mol・L-1pH为4的NaHB溶液中:c(HB-)>c(H2B.)>c(B2-) 在NaHA溶液中一定有:c(Na+)+c(H+) =c(HA)+c(OH)+c(A2-) 等物质的量浓度的 (NH4)2SO4 和(NH4)2CO3溶液中的c(NH4+):前者<后者
Na2CO3溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) NH4Cl溶液:c(NH4+)=c(Cl-) 硝酸钠与稀盐酸的混合溶液:c(Na+)=c(NO3-)
等体积等浓度的氢氧化钠与醋酸混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol·L-1 由10 mL 0.1 mol·L-1的CH3COOH溶液与10 mL 0.1 mol·L-1的NaOH溶液混合,离子浓度大小的顺序:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) 室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,浓度大小的顺序:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 常温下,0.1 mol·L-1 pH=8的NaHB溶液中:c(B2-)>c(H2B.)
pH=2的溶液中:c(H2A)+c(A2-)>c(HA-) E.点溶液中:c(Na+)-c(HA-)<0.100 mol·L.-1 c(Na+)=0.100 mol·L.-1的溶液中:c(H.+)+c(H2A)=c(OH-)+c(A2-) pH=7的溶液中:c(Na+)>2c(A2-)
酸式盐的溶液一定显酸性 只要酸与碱的物质的量浓度和体积分别相同,它们反应后的溶液就呈中性 纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等 碳酸溶液中氢离子物质的量浓度是碳酸根离子物质的量浓度的二倍
溶质的物质的量 溶质的质量分数 溶质的质量 溶质的微粒数
物质的量浓度均为0.1mol/L,3种溶液pH的大小顺序是③>②>① 物质的量浓度均为0.1 mol/L,将3种溶液稀释相同倍数,pH变化最大的是② 物质的量浓度均为0.1mol/L,分别加入25mL 0.1mol/L盐酸后,pH最大的是① pH均为9时,3种溶液的物质的量浓度的大小顺序是③>①>②
向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 0.1mol AgCl和0.1molAgI混合后加入100mL水中,所得溶液中c(Cl-)=c(I-)
)0.1mol/LNaHCO3溶液中:c(H+)+c(H2CO3)= c(CO32-)+c(OH-) ( )将稀氨水逐滴加入稀硫酸中,当溶液呈中性时,c(SO42-)>c(NH4 +) ( )相同温度下,物质的量浓度相同的Ba(OH)2溶液和氨水中c(OH-)之比是2:1 ( )常温下,0.1mol/L某一元酸(HA)溶液中c(OH-)/ c(H+)=1×10-8,该溶液中由水电离出的c(H+)=1×10-3 mol·L.-1
NaHSO3和NaHCO3的中性混合溶液中(S.和C.均用R.表示):c(Na+)=c(HRO3-)+2c(RO32-) 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl―)>c(CH3COOH) 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N.前后
3种溶液pH的大小顺序是 ③>②>① 若分别滴加25mL和上述溶液等浓度的盐酸后,pH最大的是① 若将3种溶液稀释相同倍数,pH变化最大的是② 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
酸溶液的物质的量浓度大于碱溶液 酸溶液中H+的浓度大于碱溶液中OH-的浓度 酸溶液的物质的量浓度等于碱溶液 酸溶液中H+的浓度小于碱溶液中OH-的浓度

 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的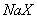 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 