你可能感兴趣的试题
正丁烷分子储存的能量大于异丁烷分子 正丁烷的稳定性大于异丁烷 异丁烷转化为正丁烷的过程是一个放热过程 异丁烷分子中的碳氢键比正丁烷的多
异丁烷分子中的碳氢键比正丁烷的多 正丁烷稳定性大于异丁烷 异丁烷转化为正丁烷的过程放热 正丁烷分子储存的能量大于异丁烷分子
CH3OH(l)的燃烧热是|ΔH1/2| CO的燃烧热是|ΔH2/2| CH3OH(l)+O2(g)= CO(g) + 2H2O(l)ΔH. =ΔH1-ΔH2+4ΔH3 ΔH3>0
正丁烷的稳定性大于异丁烷 异丁烷分子中的碳氢键比正丁烷的多 等物质的量的正丁烷能量大于异丁烷能量 异丁烷转化为正丁烷的过程是一个放热过程
-48.5 KJ·mol-1 +48.5 KJ·mol-1 -45.5KJ·mol-1 +45.5 KJ·mol-1
CO的燃料热为-566.0kJ/mol 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 完全燃烧32 g 甲醇,生成二氧化碳和水蒸气时放出的热量为908.3kJ 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH.=-1453.28kJ/mol
Q1+Q2+Q3 0.5 Q3-Q2+2Q1 0.5 Q3+Q2-2Q1 0.5(Q1+Q2+Q3)
正丁烷分子储存的能量大于异丁烷分子 正丁烷的稳定性大于异丁烷 异丁烷转化为正丁烷的过程是一个放热过程 异丁烷分子中的碳氢键比正丁烷的多
Q1+Q2+Q3 0.5Q3-Q2+2Q1 0.5Q3+Q2-2Q1 0.5(Q1+Q2+Q3)
CH3COOH(l) CH3COOH(g) CO(g) CO2(g)
由上述热化学方程式可知ΔH3<ΔH4 H2的燃烧热为d kJ·mol-1 CH3OH(g)===CO(g)+2H2(g) ΔH.=( a- b-2c)kJ·mol-1 当CO和H2的物质的量之比为1∶2时,其完全燃烧生成CO2和H2O(l)时,放出Q. kJ热 量,则混合气中CO的物质的量为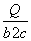 mol
mol
正丁烷分子储存的能量大于异丁烷分子 正丁烷的稳定性大于异丁烷 异丁烷转化为正丁烷的过程是一个放热过程 异丁烷分子中的碳氢键比正丁烷的多
Q1+ Q2 + Q3 0.5 Q3-Q2+2Q1 0.5 Q3+ Q2-2Q1 0.5(Q1+Q2+Q3)
—45.5kJ/mol +45.5kJ/mol —55.9kJ/mol +55.9kJ/mol
Q1+Q2+Q3 0.5 Q3-Q2+2Q1 0.5 Q3+ Q2-2Q1 0.5(Q1+Q2+Q3)

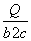 mol
mol