你可能感兴趣的试题
元素的种类取决于该元素的相对原子质量 同种元素的原子结构和质量完全相同 不同种元素的根本区别是原子核内的质子数不同 质子数相同的两种粒子属于同种元素
氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(C.1—) “毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氢、碳、氧的原子核都由质子和中子构成 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氢、碳、氧的原子核都由质子和中子构成 “毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(Cl-) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
,在反应中若得到一个电子即变成氯离子(Cl-) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
决定元素种类的是——电子数 决定元素化学性质的是——原子的核外电子数 决定元素相对原子质量的是——中子数 决定元素周期表中原子序数的是——核电荷数
氢、碳、氧的原子核都由质子和中子构成 “毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氯原子的结构示意图为  ,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氢、碳、氧的原子核都由质子和中子构成 “毒大米”中含有金属铬Cr,铬原子序数为24,则质子数和中子数都为24  氯原子的结构示意图为 在反应中若得到一个电子即变成氯离子C.1— 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氯原子的结构示意图为 在反应中若得到一个电子即变成氯离子C.1— 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
原子内的粒子分布是均匀的 原子结构与太阳系相似,电子绕着原子核运动,就像地球绕着太阳运动一样 电子是原子的组成部分,电子在原子内是静止不动的 原子核由电子、质子和中子组成
玻尔原子模型能很好地解释氢原子光谱的实验规律 卢瑟福核式结构模型可以很好地解释原子的稳定性 卢瑟福的α粒子散射实验表明原子内部存在带负电的电子 卢瑟福的α粒子散射实验否定了汤姆孙关于原子结构的“西瓜模型”
氯原子的原子结构示意图: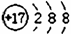 N2的结构式:N≡N 原子核内有8个中子的氧原子:
N2的结构式:N≡N 原子核内有8个中子的氧原子: O. 二氧化碳的电子式:
O. 二氧化碳的电子式: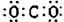
摩擦起电创造了电荷 自然界只存在正、负两种电荷 同种电荷相吸引,异种电荷相排斥 从静电现象认识到原子核是可分的
氢、碳、氧的原子核都由质子和中子构成  “毒大米”中含金属铬(Cr),铬原子序数为24,其相对原子质量为52,则质子数 和中子数都为24 氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(Cl-) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
“毒大米”中含金属铬(Cr),铬原子序数为24,其相对原子质量为52,则质子数 和中子数都为24 氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(Cl-) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氢、碳、氧的原子核都由质子和中子构成 “毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24  氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(C.1 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(C.1 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
硒属于金属元素 硒的原子序数是34 硒的原子结构示意图中x=4 硒的相对原子质量是78.96 g
氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(C.1—) “毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氢、碳、氧的原子核都由质子和中子构成 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氢、碳、氧的原子核都由质子和中子构成  “毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氯原子的结构示意图为,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
“毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氯原子的结构示意图为,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
摩擦起电创造了电荷 自然界只存在正、负两种电荷 同种电荷相吸引,异种电荷相排斥 从静电现象认识到原子核是可分的
氢、碳、氧的原子核都由质子和中子构成 “毒大米”中含有金属铬Cr,铬原子序数为24,则质子数和中子数都为24  氯原子的结构示意图为 在反应中若得到一个电子即变成氯离子C.1— 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氯原子的结构示意图为 在反应中若得到一个电子即变成氯离子C.1— 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氢、碳、氧的原子核都由质子和中子构成 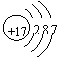 “毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
“毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
核外共有2个电子层 在化学反应中易得电子 核外电子总数为40 在化学反应中易失电子
核外有三个电子层 质子数为11 最外层电子数为1 化学反应中容易得电子

 ,在反应中若得到一个电子即变成氯离子(Cl-) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
,在反应中若得到一个电子即变成氯离子(Cl-) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
 ,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
 氯原子的结构示意图为 在反应中若得到一个电子即变成氯离子C.1— 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氯原子的结构示意图为 在反应中若得到一个电子即变成氯离子C.1— 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
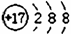 N2的结构式:N≡N 原子核内有8个中子的氧原子:
N2的结构式:N≡N 原子核内有8个中子的氧原子: O. 二氧化碳的电子式:
O. 二氧化碳的电子式: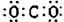
 “毒大米”中含金属铬(Cr),铬原子序数为24,其相对原子质量为52,则质子数 和中子数都为24 氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(Cl-) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
“毒大米”中含金属铬(Cr),铬原子序数为24,其相对原子质量为52,则质子数 和中子数都为24 氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(Cl-) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
 氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(C.1 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(C.1 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
 “毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氯原子的结构示意图为,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
“毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氯原子的结构示意图为,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
 氯原子的结构示意图为 在反应中若得到一个电子即变成氯离子C.1— 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
氯原子的结构示意图为 在反应中若得到一个电子即变成氯离子C.1— 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
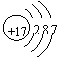 “毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷
“毒大米”中含有金属铬(Cr)。铬原子序数为24,则质子数和中子数都为24 氯原子的结构示意图为 ,在反应中若得到一个电子即变成氯离子(C.1—) 质子和中子的相对质量都约等于1,每个质子、中子都带1个单位正电荷