你可能感兴趣的试题
a<c<0 b>d>0 2a=b<0 2c=d>0
438.6 kJ/mol 241.8 kJ/mol 285.8 kJ/mol 无法确定
H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 O2前面的 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
吸热88kJ 吸热2.44kJ 放热44kJ 吸热44kJ
试管a中的气体是H2 试管b中的气体能使带火星的木条复燃 电解水产生的H2和O2的质量比为2∶1 电解水反应的化学方程式为2H2O 2H2↑+O2↑
2H2↑+O2↑
H2燃烧生成1mol H2O(g)时,放出241.8 kJ的热量 O2前面的 表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量
表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量
H2O(g)=H2(g)+1/2 O2(g) ΔH=+242 kJ/mol 2 H2(g)+O2(g)=2 H2O(g) ΔH=-484 kJ/mol H2(g)+1/2 O2(g)=H2O(g) ΔH=+242 kJ/mol 2 H2(g)+O2(g)=2 H2O(g) ΔH=+484 kJ/mol
试管a中的气体是H2 试管b中的气体能使带火星的木条复燃 产生的H2和O2的质量比为2 : 1 发生反应的化学方程式为2H2O通电2H2↑+ O2↑
2H2(g) + O2(g)= 2H2O(g) △H1 ; 2H2(g) + O2(g) = 2H2O(l) △H2 S(g) + O2(g) =SO2(g) △H1 ; S(s) + O2(g) = SO2(g) △H2 CO(g) + 1/2 O2(g) = CO2(g) △H1 ;2CO(g) + O2(g) = 2CO2(g) △H2 C.(s)+H2O(g)=CO(g)+H2(g) △H1 ;CaO(s)+H2O(l)===Ca(OH)2(s) △H2
表示氧化铜加氢气等于铜和水。 表示一个氧化铜分子和一个氢气分子反应生成一个铜原子和一个水分子。 表示CuO 、H2 、Cu 、H2O的质量比为40:1:32:9 表示氧化铜和氢气在加热的条件下反应生成铜和水。
9:1:16 9:1:8 9:2:8 10:1:9

 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
 2H2↑+O2↑
2H2↑+O2↑ 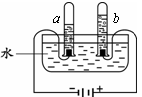
 表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量
表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量