
可能为圆弧c a.b.c都有可能
 可能为直线
可能为直线 可能为圆弧
可能为圆弧
 、
、 、
、 都有可能
都有可能
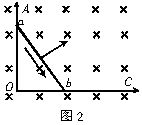
如图中轨迹3所示 垂直纸面向里




 A. 感应电流方向始终是b﹣a 感应电流方向先是b→a,后变为a→b 受磁场力方向与ab垂直,如图中箭头所示方向 受磁场力方向与ab垂直,开始如图中箭头所示方向,后来变为与箭头所示方向相反
A. 感应电流方向始终是b﹣a 感应电流方向先是b→a,后变为a→b 受磁场力方向与ab垂直,如图中箭头所示方向 受磁场力方向与ab垂直,开始如图中箭头所示方向,后来变为与箭头所示方向相反

 直线
直线 圆弧
圆弧 不能确定
不能确定
