你可能感兴趣的试题
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
电离平衡常数越小,表示弱电解质的电离能力越弱 电离平衡常数与温度无关 不同浓度的同一弱电解质,其电离平衡常数不同 多元弱酸各步电离平衡常数相互关系为:K1〈K2〈K3
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变小 温度高时溶液中的氢离子浓度变小
不同浓度的同一弱电解质,其电离平衡常数(K.)不同 电离平衡常数(K.)越小,表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K.1<K.2<K.3 CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小
在18℃时溶解度比25℃时小 的电离是一个放热过程 温度高时电离度变大 温度低时溶液中的氢氧根离子浓度变大
在18℃时溶解度比25℃时小 的电离是一个放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
CH3COONa NaClO Na2CO3 Na3PO4
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
在18℃时溶解度比25℃时小 电离是一个放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式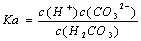 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变小 温度高时溶液中的氢氧根离子浓度变小
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变大 温度高时溶液中的氢离子浓度变小
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变大 温度越低时溶液中的氢氧根离子浓度变得越大
碳酸的酸性强于氢硫酸 多元弱酸的酸性主要由第一步电离决定 多元弱酸的各步电离之间无影响 向弱酸溶液中加少量NaOH固体,电离常数不变
电离平衡常数能衡量电解质电离的相对强弱 电离平衡常数不随浓度的变化而变化 电离平衡常数与温度有关 电离平衡常数不随任何条件而改变
在18℃时溶解度比25℃小 的电离过程是放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
电离度越大,电离平衡常数越大; 浓度越稀,电离度越大,电离平衡常数越大; 在相同的温度下电离度可变,而电离平衡常数不变; 多元弱酸的每一步电离平衡常数是相同的

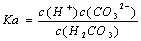 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1