你可能感兴趣的试题
锌片和铜片均有气泡产生 溶液的pH增大,Zn2+浓度增大 溶液中的SO42-向正极移动 电子从锌片流向铜片
Zn是负极,发生还原反应 一段时间后,铜片质量减轻 电流从铜片经导线流向锌片 一段时间后,电解质溶液的酸性保持不变
SO42- 向负极区域移动 正极有O2逸出 电子通过导线由铜片流向锌片 铜片上有H2逸出
两烧杯中锌片均发生氧化反应 甲中铜片是正极,乙中铜片是负极 两烧杯中溶液的pH均增大 产生气泡的速度甲比乙慢 
Zn是负极,发生还原反应 电流从锌片流向铜片 一段时间后,铜片质量减轻 该装置将化学能转变为电能
在锌片一端发生的反应是氧化反应 在铜片一端发生的反应是氧化反应 锌片是原电池的正极 铜片是原电池的正极
实验①、②说明锌能与稀硫酸反应而铜不能 实验③说明发生原电池反应时会加快化学反应速率 实验③说明在该条件下铜可以与稀硫酸反应生成氢气 实验④说明该原电池中铜为正极、锌为负极
电流从铜片经导线流向锌片 该装置将电能转变为化学能 一段时间后,铜片质量减轻 锌片发生还原反应 
溶液的pH增大 溶液中的Zn2+浓度增大 溶液中的SO42— 浓度增大 溶液的密度增大
B两块锌片,A片跟足量的稀硫酸反应,B片先煅烧成氧化锌,再与足量稀硫酸反应,则A.B两块锌片反应制得的硫酸锌的质量( )A.相等 A片制得的多 B片制得的多 无法比较
锌片上有气泡产生 锌片为负极,铜片发生氧化反应 电解质溶液中的H+向铜极移动 电子流动方向为:锌极→导线→铜极→电解质溶液→锌极
铜电极上的反应为Cu-2e-==Cu2+ 放电时溶液中的阳离子向锌片移动 电池正极发生氧化反应 该电池的负极材料是锌片 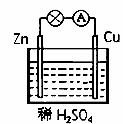
铜片上发生了还原反应 电子通过导线由铜片流向锌片 正极有O2逸出 正极附近的SO42—离子浓度逐渐增大



