你可能感兴趣的试题
加入少量的NaOH溶液,醋酸的电离平衡向右移动 加水稀释后,醋酸的电离度增加 加人浓醋酸,由于增加反应物浓度,使醋酸的电离平衡向右移动,使醋酸电离度增加 加入少量的HCI,使醋酸的电离度减小
在蒸馏水中滴加浓硫酸,Kw不变 中和等体积等物质的量浓度的盐酸和醋酸,所消耗的氢氧化钠的物质的量相同 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 向起始c(H+)相同的盐酸与醋酸溶液中加入足量等规格的锌片,反应过程中的平均速率 一样大
加水稀释后,醋酸的电离度增加 加入浓醋酸,由于增加反应物浓度,使醋酸的电离平衡向右移动,使醋酸电离度增加 加入少量的NaOH溶液,醋酸的电离平衡向右移动 加入少量的HCl,使醋酸的电离度减小
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,c(H+)亦增大 再加入10mL pH=11 NaOH溶液,混合液pH=7 溶液中 不变
不变
溶液中导电粒子的数目减少 溶液中 不变 醋酸的电离程度增大,n(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,n(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
溶液中导电粒子的数目减少 溶液中 不变 醋酸的电离程度增大,C.(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,C.(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
醋酸的电离程度增大,C.(H+)亦增大 再加入10ml pH=11的NaOH溶液,混合液pH=7 溶液中导电粒子的数目减少 溶液中 不变
不变
溶液中导电粒子的数目减少 溶液中 不变 醋酸电离程度增大,C.(H.+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸电离程度增大,C.(H.+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,[H+]减小 再加入10mLpH=11NaOH 溶液,混合液pH=7 溶液中由水电离出的[H+]=1×10-11mol/L
加水稀释,促进电离,溶液的导电性增强 加入少量醋酸钠晶体,电离程度增大 加水稀释,Ka不会改变 升高温度,溶液中粒子浓度都增大
使用如图所示装置验证K.a(CH3COOH)>K.a(H2CO3)>K.a(H2SiO3) 0.1 mol·L-1的醋酸中加入水或加入冰醋酸均可使醋酸电离平衡向电离方向移动 等物质的量浓度的CH3COONa和Na2CO3溶液,后者溶液中水的电离程度大 等pH的醋酸和碳酸,分别加水稀释后溶液的pH仍相等,则醋酸中加入水的体积少
溶液中导电粒子的数目减少 溶液中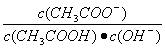 不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mLpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mLpH=11的NaOH溶液,混合液pH=7
加入少量的NaOH溶液,醋酸的电离平衡向右移动 加水稀释后,醋酸的电离度增加 加入浓醋酸,由于增加反应物浓度,使醋酸的电离平衡向右移动,使醋酸电离度增加 加入少量的HCl,使醋酸的电离度减小
溶液中导电粒子的数目减少 溶液中 不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
0.1mol/L醋酸溶液加水稀释,电离平衡正移,电离平衡常数增大 0.1mol/L醋酸溶液中加入锌粒,电离平衡正移,c(H+)增大 0.1mol/L醋酸钠溶液中加入醋酸钠固体,水解平衡正移,c(OH-)增大 在AgCl饱和溶液中加入AgCl固体,沉淀溶解平衡正移,c(Ag+)增大
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,减小 再加入10mL pH=11 NaOH溶液,混合液pH=7 溶液中由水电离出的=1×10-11 mol·L-1
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,c(H+)亦增大 再加入10mL pH=11 NaOH溶液,混合液pH=7 溶液中 不变
不变

 不变
不变
 不变 醋酸的电离程度增大,n(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,n(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
 不变 醋酸的电离程度增大,C.(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,C.(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
 不变
不变
 不变 醋酸电离程度增大,C.(H.+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸电离程度增大,C.(H.+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
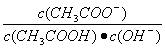 不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mLpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mLpH=11的NaOH溶液,混合液pH=7
 不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
 不变
不变