你可能感兴趣的试题
室温下,将pH=2的醋酸与pH=12的NaOH溶液等体积混合,溶液显中性 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
溶液中导电粒子的数目减少 溶液中 不变
不变
醋酸的电离程度增大,c(H+)亦增大 再加入10 mL pH=11的NaOH溶液,混合液pH=7
溶液中导电粒子的数目减少 溶液中c(OH﹣)亦增大 醋酸的电离程度增大,c(H+)亦增大 再加入10mL pH=11的NaOH溶液,混合液的pH=7
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,c(H+)亦增大 再加入10mL pH=11 NaOH溶液,混合液pH=7 溶液中 不变
不变
溶液中导电粒子的数目减少 溶液中 不变 醋酸的电离程度增大,n(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,n(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
溶液中导电粒子的数目减少 溶液中 不变 醋酸的电离程度增大,C.(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,C.(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
溶液中导电粒子的数目减少 溶液中 不变 醋酸的电离程度增大,c(H+)亦增大 再加入9mLpH=11的NaOH溶液,混合液pH <7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入9mLpH=11的NaOH溶液,混合液pH <7
醋酸的电离程度增大,C.(H+)亦增大 再加入10ml pH=11的NaOH溶液,混合液pH=7 溶液中导电粒子的数目减少 溶液中 不变
不变
溶液中导电粒子的数目减少 溶液中 变大 醋酸的电离程度增大,c(OH-)亦增大 再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应
变大 醋酸的电离程度增大,c(OH-)亦增大 再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应
溶液中导电粒子的数目减少 溶液中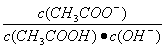 不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mLpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mLpH=11的NaOH溶液,混合液pH=7
95℃纯水的pH<7,说明加热可导致水呈酸性 25℃时,在纯水中加入强碱溶液不会影响水的离子积常数 pH=3的醋酸溶液加水稀释10倍后pH=4 pH=3和pH=5的盐酸各10mL混合所得溶液的pH=4
溶液中导电粒子的数目增加,导电性增强 氨水的电离程度增大,[OH-]减小 再加入10mL pH=3 HCl溶液,混合液pH=7 溶液中由水电离出的[OH-]=1×10-3 mol·L-1
a<b a>b a=b=10 mL a=b>10 mL
溶液中导电粒子的数目增加,导电性增强 氨水的电离程度增大,[OH﹣]增大 再加入10mL pH=3 HCl溶液,混合液pH>7 溶液中由水电离出的[OH﹣]=1×10﹣3 mol•L.﹣1
溶液中导电粒子的数目减小 溶液中的 不变 醋酸的电离程度增大,c(H+)也增大 再加入10 mL pH=11的NaOH溶液,混合液的pH=7
不变 醋酸的电离程度增大,c(H+)也增大 再加入10 mL pH=11的NaOH溶液,混合液的pH=7
溶液中导电粒子的数目减少 溶液中 不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,减小 再加入10mL pH=11 NaOH溶液,混合液pH=7 溶液中由水电离出的=1×10-11 mol·L-1
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,c(H+)亦增大 再加入10mL pH=11 NaOH溶液,混合液pH=7 溶液中 不变
不变
溶液中导电粒子的数目减少 溶液中 (CH3COOH)减少 C.醋酸的电离程度增大,c(H+)也增大 再加入10 mL pH=11的NaOH溶液,混合液的pH=7
溶液中导电粒子的数目增加,导电性增强 醋酸的电离程度增大,[H+]减小 再加入10mLpH=11NaOH 溶液,混合液pH=7 溶液中由水电离出的[H+]=1×10-11mol/L

 不变
不变 不变
不变
 不变 醋酸的电离程度增大,n(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,n(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
 不变 醋酸的电离程度增大,C.(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,C.(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
 不变 醋酸的电离程度增大,c(H+)亦增大 再加入9mLpH=11的NaOH溶液,混合液pH <7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入9mLpH=11的NaOH溶液,混合液pH <7
 不变
不变
 变大 醋酸的电离程度增大,c(OH-)亦增大 再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应
变大 醋酸的电离程度增大,c(OH-)亦增大 再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应
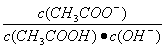 不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mLpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mLpH=11的NaOH溶液,混合液pH=7
 不变 醋酸的电离程度增大,c(H+)也增大 再加入10 mL pH=11的NaOH溶液,混合液的pH=7
不变 醋酸的电离程度增大,c(H+)也增大 再加入10 mL pH=11的NaOH溶液,混合液的pH=7
 不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
不变 醋酸的电离程度增大,c(H+)亦增大 再加入10mlpH=11的NaOH溶液,混合液pH=7
 不变
不变