你可能感兴趣的试题
负极反应式为CH4 + 10OH--8e-=== CO32-+ 7H2O 正极反应式为O2 + 2H2O + 4e-=== 4OH- 随着不断放电,电解质溶液碱性不变 甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
甲、乙中电解质溶液的pH都增大 理论上甲中每消耗22.4 L CH4(标准状况下), 乙中产生4 mol Cl2 乙中电解MgCl2溶液的总反应为2Cl-+2H2O Cl2↑+H2↑+2OH- 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =
Cl2↑+H2↑+2OH- 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =  +7H2O
+7H2O
该能量转化系统中的水是可以循环的 燃料电池系统产生的能量实际上来自于太阳能 水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ 燃料电池放电时的正极反应:H2-2e-+2OH-=2H2O
负极反应式为CH4 + 10OH--8e-=== CO32-+ 7H2O 正极反应式为O2 + 2H2O + 4e-=== 4OH- 随着不断放电,电解质溶液碱性不变 甲烷燃料电池也可以用稀硫酸做电解质溶液
甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大 该燃料电池在使用过程中电解质溶液的浓度和性质均发生变化 负极反应式:CH4+3H2O-8e-=CO32-+7H+ 正极反应式:2O2+4H2O+8e-=8OH-
该能量转化系统中的水是可以循环的 燃料电池系统产生的能量实际上来自于太阳能 水电解系统中的阳极反应:4OH--4e-=2H2O.+O2↑ 燃料电池放电时的正极反应:H2-2e-+2OH-=2H2O.
该能量转化系统中的水是可以循环的 燃料电池系统产生的能量实际上来自于太阳能 水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ 燃料电池放电时的正极反应:H2-2e-+2OH-=2H2O
随着反应的进行,电解质溶液的pH保持不变 负极的电极反应式为CH4+10OH--8e-===CO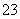 +7H2O 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 甲烷燃料电池的能量利用率比甲烷燃烧的大
+7H2O 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 甲烷燃料电池的能量利用率比甲烷燃烧的大
a极是负极 正极的电极反应是:O2+2H2O+4e-=4OH- 电子由b通过灯泡流向a 氢氧燃料电池是环保电池
该能量转化系统中的水是可以循环的 燃料电池系统产生的能量实际上来自于太阳能 水电解系统中的阳极反应:4OH--4e- 2H2O+O2↑ 燃料电池放电时的正极反应:H2-2e-+2OH-
2H2O+O2↑ 燃料电池放电时的正极反应:H2-2e-+2OH- 2H2O
2H2O
燃料电池的优点是能量转化率很高,反应物不必全部储藏在电池内 电解质为KOH,氢气和氧气构成的燃料电池在放电过程中KOH溶液的浓度不变 电池充电时,原电池的正极变成了电解池的阳极 钢铁发生吸氧腐蚀时,正极反应为O2+4e-+2H2O===4OH-

 Cl2↑+H2↑+2OH- 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =
Cl2↑+H2↑+2OH- 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =  +7H2O
+7H2O
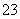 +7H2O 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 甲烷燃料电池的能量利用率比甲烷燃烧的大
+7H2O 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 甲烷燃料电池的能量利用率比甲烷燃烧的大
 2H2O+O2↑ 燃料电池放电时的正极反应:H2-2e-+2OH-
2H2O+O2↑ 燃料电池放电时的正极反应:H2-2e-+2OH- 2H2O
2H2O