由乙烯和氯化氢在一定条件下发生加成反应
由乙烷和氯气在一定条件下发生取代反应
由乙烷和氯气在一定条件下发生加成反应
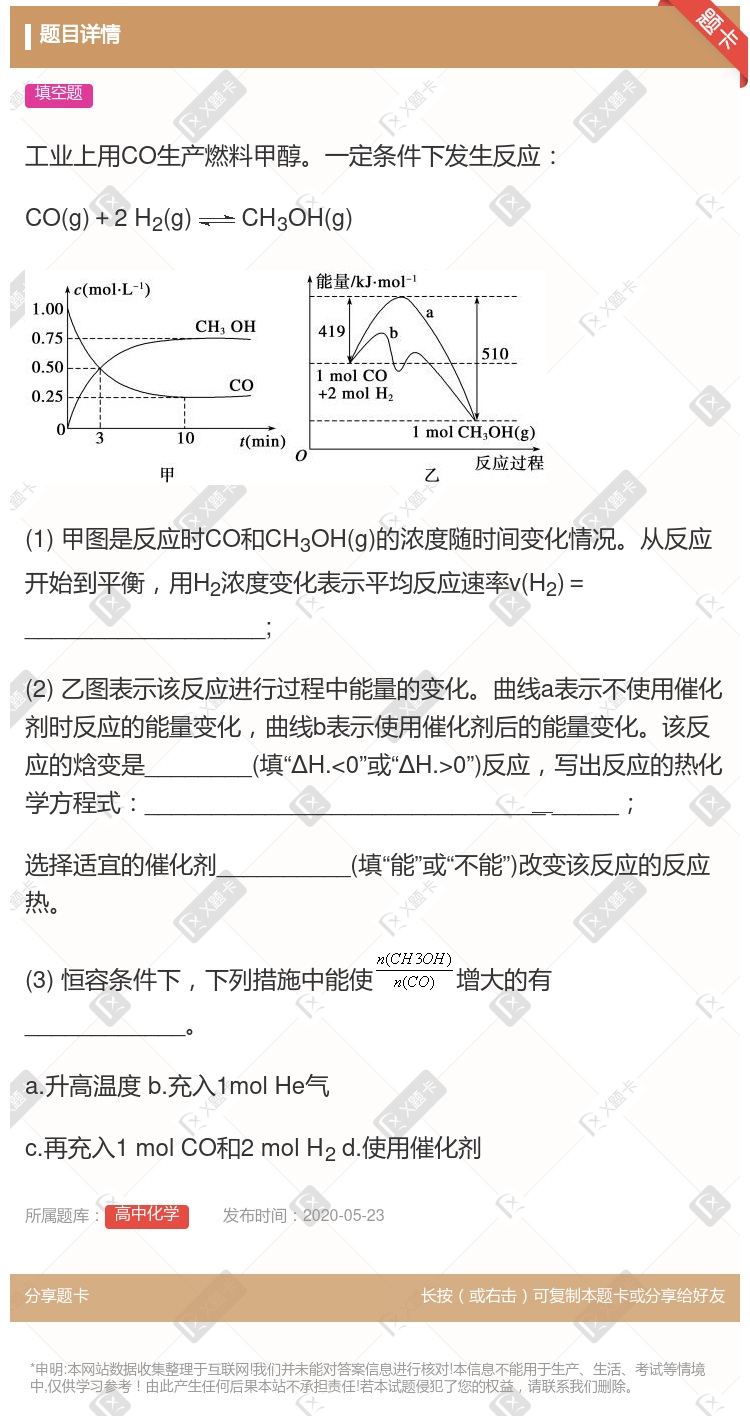
 CH3OH 反应进行至3分钟时,正、逆反应速率相等 反应至10分钟,ʋ(CO) = 0.075 mol/L·min 增大压强,平衡正向移动,K.增大
CH3OH 反应进行至3分钟时,正、逆反应速率相等 反应至10分钟,ʋ(CO) = 0.075 mol/L·min 增大压强,平衡正向移动,K.增大
 )与等物质的量的Br 2发生加成反应 2-氯丁烷(CH 3CHClCH 2CH 3)与NaOH乙醇溶液共热 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 甲醇在铜催化和加热条件下生成的产物
)与等物质的量的Br 2发生加成反应 2-氯丁烷(CH 3CHClCH 2CH 3)与NaOH乙醇溶液共热 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 甲醇在铜催化和加热条件下生成的产物
 )与等物质的量的Br2发生加成反应 2—氯丁烷(
)与等物质的量的Br2发生加成反应 2—氯丁烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 2—丙醇一定条件下发生消去反应
)与NaOH乙醇溶液共热发生消去HCl分子的反应 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 2—丙醇一定条件下发生消去反应
 )与等物质的量的Br2发生加成反应 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 甲醇在铜催化和加热条件下生成的产物
)与等物质的量的Br2发生加成反应 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 甲醇在铜催化和加热条件下生成的产物