你可能感兴趣的试题
常温下,0.1 mol·L.-1氨水的电离常数K.约为1×10-5mol·L.-1 a、b之间的点一定满足:c(NH )>c(Cl-)>c(OH-)>c(H+) c点溶液中c(NH
)>c(Cl-)>c(OH-)>c(H+) c点溶液中c(NH )=c(Cl-) d点代表两溶液恰好完全反应
)=c(Cl-) d点代表两溶液恰好完全反应
0.1 mol•L-1NaHCO3溶液: K+、Fe3+、Cl-、NO3- 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ 常温下由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Na+、SO32-、NO3- 常温下在c(H+)=1×10-13mol·L-1的溶液中: Na+、K+、SO42-、CO32-
M点溶液中水的电离程度比原溶液大 随着NaOH的加入,NH4+与NH3·H2O物质的量总量减少 当n(NaOH)=0.05mol 时,溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) 在M.点时,n(OH-)+0.05=a+n(H+)
加入适量的NaCl,可使c(NH )=c(Cl-) 滴加几滴浓氨水,c(NH
)=c(Cl-) 滴加几滴浓氨水,c(NH )减小 滴加几滴浓盐酸,
)减小 滴加几滴浓盐酸, 的值减小 1.0 mol·L-1的NH4Cl溶液中c(NH
的值减小 1.0 mol·L-1的NH4Cl溶液中c(NH )比该混合溶液中的大
)比该混合溶液中的大
0.1mol・L-1NaHCO3溶液中离子浓度间的关系:[Na+]=2[ ]+[
]+[ ]+[H2CO3]
]+[H2CO3]
0.1mol・L-1NH4Cl溶液和0.1mol・L-1NH3・H2O溶液等体积混合后离子浓度间的关系:[Cl-]> >[H+]>[OH-]
>[H+]>[OH-]
常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:[Na+]=[CH3COO-]
常温下,在pH=1的溶液中Fe2+、 、ClO-、Na+能大量共存
、ClO-、Na+能大量共存
M点溶液中水的电离程度比原溶液大 在M.点时,n(OH-)-n(H+)=(a -0.05)mol 随着NaOH的加入,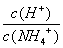 不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
常温下pH=7的溶液中:Fe3+、Mg2+、SO 、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH
、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH 可能大量共存
可能大量共存
常温下将0.1 mol·L-1 NH4Cl溶液与0.05 mol·L-1 NaOH溶液等体积混合, c (Cl-)> c (Na+)> c(NH4+)> c (OH-)> c (H+) 常温下物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>② 0.1mol·L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A.) 在相同条件下,将足量AgCl加入等体积的①0.01 mol·L-1 KCl②0.1 mol·L-1 KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性一定有:c(CH3COOH)= c(Cl-) 某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)= c(H+)+c(H2A.) 常温下pH为2的盐酸,H2O电离出的c(H+)=1.0×10-2 mol·L-1 常温下,将50 mL0.l mol·L-1的盐酸与l00 mL0.1 mol·L-1的氨水混合,所得溶液中: c(NH3·H2O)>c(Cl一)>c(NH4+)> c(OH-)>c(H+)
NH4+离子浓度由大到小的顺序为② > ④ > ① > ③ NH3·H2O分子浓度由大到小的顺序为② > ③ > ① > ④ 溶液的pH由大到小的顺序为③ > ② > ① > ④ 溶液中的离子总浓度由大到小的顺序为④ > ① > ② > ③
常温下,0.l mol/L氨水的电离常数K.约为l×l0-5 mol.L-1 a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)> c(H+) c点溶液中c(NH4+)=c(Cl-) d点代表两溶液恰好完全反应
常温下将0.1 mol·L.-1NH4Cl溶液与0.05 mol·L.-1NaOH溶液等体积混合,c(Cl-) > c(Na+) > c(NH4+) > c (OH-) > c (H+) 常温下,物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>② 0.1mol·L.-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A.) 在相同条件下,将足量AgCl加入等体积的①0.01 mol•L-1AgNO3溶液②0.1 mol•L-1KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③
常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 常温下,将pH =10的氨水稀释后,溶液中所有离子浓度都减小 常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+)
常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-) 常温下0.1 mol.L.-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L.-l 常温下向10 mL0.1 mol.L.-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中, 将减小
将减小
0.1mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) 0.1mol·L-1NH4Cl和0.1mol·L-1NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) 常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存
0.1mol/L.的NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) 0.1mol/L NH4Cl溶液中离子浓度关系: c(Cl-)>c(NH4+)>c(H+)>c(OH-) 常温下,在PH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的PH=7,则混合液中: c(Na+)=c(CH3COO-)
常温下醋酸分子不可能存在于pH>7的碱性溶液中 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)

 )>c(Cl-)>c(OH-)>c(H+) c点溶液中c(NH
)>c(Cl-)>c(OH-)>c(H+) c点溶液中c(NH )=c(Cl-) d点代表两溶液恰好完全反应
)=c(Cl-) d点代表两溶液恰好完全反应
 )=c(Cl-) 滴加几滴浓氨水,c(NH
)=c(Cl-) 滴加几滴浓氨水,c(NH )减小 滴加几滴浓盐酸,
)减小 滴加几滴浓盐酸, 的值减小 1.0 mol·L-1的NH4Cl溶液中c(NH
的值减小 1.0 mol·L-1的NH4Cl溶液中c(NH )比该混合溶液中的大
)比该混合溶液中的大
 ]+[
]+[ ]+[H2CO3]
]+[H2CO3] >[H+]>[OH-]
>[H+]>[OH-] 、ClO-、Na+能大量共存
、ClO-、Na+能大量共存
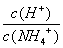 不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
不断增大 当n(NaOH)=0.05mol时溶液中有: c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
 、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH
、Cl-能大量共存 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳: ClO-+CO2+ H2O =HClO+HCO3- 一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的量相同 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42 -、NH 可能大量共存
可能大量共存
 将减小
将减小