你可能感兴趣的试题
pH=3,pH=4 pH=3,pH=10 pH=7,pH=11 pH=1,pH=7
NaCl、稀HCl、KOH CuSO4、KNO3、BaCl2 FeCl3、NaOH、HNO3 NH3·H2O、Na2CO3、KCl
PH=3 PH=4 PH=3 PH=10 PH=7 PH=11 PH=1 PH=7
pH=3 pH=4 pH=11 pH=7 pH=6 pH=8 pH=0 pH=5
含等物质的量的HNO3、Na2CO3、CH3COOH溶液混合 pH= 2的盐酸和 pH=12的氨水等体积混合 pH= 3的某酸和 pH= 11的某碱等体积混合 pH=2的CH3COOH和pH=12的NaOH溶液等体积混合
室温下,CH3COOH分子可能存在于pH=8的碱性溶液中 在0.1mol・L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减少 在c(H+)=c(OH-)的溶液中,AlO2-不可能大量存在 由水电离出的c(OH-)=1×10-12mol・L-1的溶液中,Al3+不可能大量存在
pH=3 pH=4 pH=11 pH=7 pH=6 pH=8 pH=0 pH=5
pH=3 pH=4 pH=3 pH=10 pH=7 pH=11 pH=1 pH=7
无色溶液中可能大量存在Fe3+、NH4+、Cl-、S2- pH=1的溶液中可能大量存在Na+、NH4+、NO3-、I- 使酚酞变红色的溶液中可能大量存在Na+、K.+、Cl-、HCO3- 由水电离的c(H+)=1×10-13mol·L-1的溶液中可能大量存在Na+、AlO2、 Cl-、SO42-
室温下,HClO分子不可能存在于pH>7的溶液中; 在[OH-]=[H+]的溶液中,AlO2-不可能大量存在; 在NaAlO2溶液中,HCO3-不可能大量存在; 在水溶液中石炭酸比碳酸容易电离。
室温下,乙酸分子可以存在于pH=8的碱性溶液中 在0.1mol・L-1氢溴酸中加入适量的蒸馏水,溶液中氢离子的浓度减小 在水电离出c(OH-)=1×10-12mol・L-1的溶液中,Al3+不可能大量存在 AlCl3在溶液中,HCO3-不可能大量存在
无色溶液中:HCO3-、Na+、Cl-、OH- pH=11的溶液中:S2-、K+、CO32-、Cl- pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3- pH=2的溶液中:Fe3+、SO42-、K+、SCN-
25℃时,pH =3的某酸溶液与pH =11的NaOH溶液等体积混合后,溶液pH≤7 将某电解质溶液加水稀释,溶液中离子浓度都减小 酸所能提供的H+与碱所能提供的OH-的物质的量相等即酸碱完全中和 在摩尔盐溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
pH=11的溶液中: 水电离的浓度为
水电离的浓度为 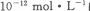 的溶液中:
的溶液中: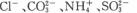 使石蕊变红的溶液中:
使石蕊变红的溶液中: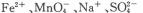 中性溶液中:
中性溶液中:
Na2SO4、KCl HCl、K2CO3 CuCl2、KNO3 NaCl、NH4Cl
常温下,将pH=3的盐酸与pH=b的氨水等体积混合,混合液pH=7,则b<11 pH=11的Na2CO3溶液加水稀释,溶液中所有的离子浓度均降低 常温下醋酸分子不可能存在于pH>7的碱性溶液中 0.1mol/L酸HA与0.1mol/L NaOH溶液等体积混合后pH>7,则c(Na+)=c(A.-)+c(HA)=0.1mol/L
在PH=1的溶液中:NaCl、Na2CO3、Na2SO4 在PH=2的溶液中:KCl、 Na2SO4 HNO3 在PH=13的溶液中:BaCl2、Na2CO3、NaOH 在PH=14的溶液中:Fe Cl3、Ba(NO3)2、CaCl2
25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 同温度、同浓度的NaCl溶液和氨水的导电能力 25℃时,pH均为13的氨水和NaOH溶液中溶质的物质的量浓度

 水电离的浓度为
水电离的浓度为 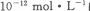 的溶液中:
的溶液中: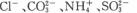 使石蕊变红的溶液中:
使石蕊变红的溶液中: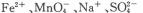 中性溶液中:
中性溶液中: