你可能感兴趣的试题
向该容器中充人N2,平衡正向移动 降低温度能使混合气体的密度增大 该反应达平衡时H2的转化率为20% 研发高效催化剂可大大提高N2的转化率
V(H2)=0.03mol/(L·min ) V(N2)=0.02mol/(L·min) V(NH3)=0.17mol/(L·min ) V(NH3)=0.01mol/(L·min)
0.02mol/(L·s) 0.04mol/((L·s) 0.01mol/((L·s) 0.2mol/((L·s)
用X.表示该化学反应速率比用Y.表示的要快 该反应的化学方程式:3X+Y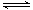 2Z 若在3min后,把Z.从反应体系中分离,平衡不移动 反应开始至2min,Z.的平均反应速率:0.1mol/(L·min)
2Z 若在3min后,把Z.从反应体系中分离,平衡不移动 反应开始至2min,Z.的平均反应速率:0.1mol/(L·min)
若x<4,则2c1若x=4,则ω1=ω3 无论x的值是多少,均有2ρ1=ρ2内 容器甲中反应从开始到平衡的平均反应速率可能为vA.=0.3mol·L-1·min-1
VN2=0.005mol/(L•s) VH2=0.015mol/(L•s) VNH3=0.01mol/(L•s) VNH3=0.02mol/(L•s)
v(H2)=0.03 mol/(L·min) v(N2)=0.02 mol/(L·min) v(NH3)=0.01 mol/(L·min) v(NH3)=0.17 mol/(L·min)
v(NH3)=0.1 mol/(L·min) v(N2)=0.02 mol/(L·min) v(H2)=0.015 mol/(L·min) v(NH3)=0.17 mol/(L·min)
V(H2)=0.03mol/(L·min) V(N2)=0.02mol/(L·min) V(NH3)=0.17mol/(L·min) V(NH3)=0.01mol/(L·min)
0.4mol/(L•s) 0.3mol/(L•s) 0.2mol/(L•s) 0.1mol/(L•s)
0.24 mol/(L·s) 0.16mol/(L·s) 0.08 mol/(L·s) 0.32 mol/(L·s)

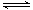 2Z 若在3min后,把Z.从反应体系中分离,平衡不移动 反应开始至2min,Z.的平均反应速率:0.1mol/(L·min)
2Z 若在3min后,把Z.从反应体系中分离,平衡不移动 反应开始至2min,Z.的平均反应速率:0.1mol/(L·min)