你可能感兴趣的试题
Na+ CO32- OH- Ag+ NO3- NH4+ K+ Cu2+ NO3- SO42- NO3- H+
原试液中可能含有 CO 、K+、NH4+ 无法确定沉淀A.的成分 无法确定原试液中有Al3+、K +、Clˉ 原溶液中一定存在的离子为NH
、K+、NH4+ 无法确定沉淀A.的成分 无法确定原试液中有Al3+、K +、Clˉ 原溶液中一定存在的离子为NH 、Fe2+、SO
、Fe2+、SO 、NO3-
、NO3-
1O2-中的若干种离子,离子浓度均为0.1mol/L。某同学进行了如下实验:  下列说法正确的是 A.无法确定原试液中是否含有Al3+、Cl- 滤液X.中大量存在的阳离子有NH4+、Fe2+和Ba2+ 无法确定沉淀C.的成分 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
下列说法正确的是 A.无法确定原试液中是否含有Al3+、Cl- 滤液X.中大量存在的阳离子有NH4+、Fe2+和Ba2+ 无法确定沉淀C.的成分 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
肯定不含I- 可能含SO42- 肯定含有SO32- 肯定含有NH4+
CaCl2 CH3COONa (NH4)2SO4 K3PO4
K+ SO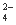 Ba2+ NH
Ba2+ NH
可能含有K+ 肯定含有NO3−、SO42−、NH4+、CO32− 一定不含有NO3− 一定含有K+
K+ SO Ba2+ NH
Ba2+ NH
原溶液中存在NH4+、Fe2+、Cl-、SO42- 滤液X.中大量存在的阳离子有NH4+、Fe2+和Ba2+ 无法确定沉淀C.的成分 无法确定原试液中是否含有Al3+、Cl-
该溶液中肯定不含I- 该溶液中可能含有Ba2+ 该溶液中肯定含有NH4+ 该溶液中可能含有MnO4-
无法确定原溶液中是否含有Al3+ Cl-
滤液X.中大量存在的阳离子有NH4+ ,Fe2+和Ba2+
沉淀C.只有一种成分
原溶液中一定大量存在的离子只有:NH4+ ,Fe2+,Cl-,SO42-
Ca(No3) 2 (NH4) 2 SO4 (NH4) NO3 KNO3 NaNO3 FeSO4
KNO3 NH4NO3 (NH4)2SO4 k2CO3
若Y.是盐酸,则Oa段转化为沉淀的离子(表中,下同)只有AlO2﹣ 若Y.是盐酸,则溶液中可能含有的阳离子是Al3+ 若Y.是NaOH溶液,则bc段反应的离子方程式为 Al(OH)3+OH﹣═AlO2﹣+2H2O 若Y.是NaOH溶液,则X.溶液中只存在四种离子是:Al3+、Fe3+、NH4+、Cl﹣
原溶液中存在NH4+、Fe2+、Cl-、SO42- 滤液X.中大量存在的阳离子有NH4+、Fe2+和Ba2+ 无法确定沉淀C.的成分 无法确定原试液中是否含有Al3+、Cl-
向0.1 mol·L-1NH4Cl溶液中通入一定量氨气:c(Cl-)>c(NH4+)>c(OH-)>c(H+) 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) 已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 浓度均为0.1 mol·L-1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中, c(NH )的大小顺序为:③>②>①
)的大小顺序为:③>②>①
(NH4)2SO4属于铵态氮肥,能促进植物生长茂盛,叶色浓绿 长期施用(NH4)2SO4会导致土壤酸化板结 草木灰(主要含K2CO3)可改良酸性土壤,说明K2CO3的溶液呈碱性 为了防止土壤酸化,施用(NH4)2SO4的同时应加入Ca(OH)2
10mL 1mol/L (NH4)2SO4溶液 50mL 0.2mol/L NH4Cl溶液 10mL0.2mol/L(NH4)2SO4溶液 200mL 0.1mol/L NH4NO3溶液
该溶液中一定不含NO3- 该溶液中一定含K+,且c(K+)≥0.1mol/L 该溶液中可能含K+ 该溶液中肯定含有NO3‑、SO42-、NH4+、CO32-

 、K+、NH4+ 无法确定沉淀A.的成分 无法确定原试液中有Al3+、K +、Clˉ 原溶液中一定存在的离子为NH
、K+、NH4+ 无法确定沉淀A.的成分 无法确定原试液中有Al3+、K +、Clˉ 原溶液中一定存在的离子为NH 、Fe2+、SO
、Fe2+、SO 、NO3-
、NO3-
 下列说法正确的是 A.无法确定原试液中是否含有Al3+、Cl- 滤液X.中大量存在的阳离子有NH4+、Fe2+和Ba2+ 无法确定沉淀C.的成分 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
下列说法正确的是 A.无法确定原试液中是否含有Al3+、Cl- 滤液X.中大量存在的阳离子有NH4+、Fe2+和Ba2+ 无法确定沉淀C.的成分 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
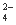 Ba2+ NH
Ba2+ NH
 Ba2+ NH
Ba2+ NH
 )的大小顺序为:③>②>①
)的大小顺序为:③>②>①