你可能感兴趣的试题
摩尔是化学上常用的一个物理量 用托盘天平称取25.20 gNaCl 配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 某物质含有6.02×1023个微粒,含有这个数目微粒的物质不一定是1 mol
0.1 mol/L的NH4Cl溶液:c(Cl-)>c(NH )>c(OH-)>c(H+) 0.1 mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) pH=4的FeCl3溶液:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) pH=11的CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)
)>c(OH-)>c(H+) 0.1 mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) pH=4的FeCl3溶液:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) pH=11的CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)
pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2:三种溶液中NH4+的浓度:②>③>① 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N.前>N后
溶液的上层浓度小,下层浓度大 溶液蒸干后,均能得到固体溶质 溶液中只有一种溶质时,溶液为纯净物 物质在溶解得到溶液的过程中,通常有放热或吸热的现象出现
溶度积小的沉淀可以转化为溶度积更小的沉淀 若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶度积相同
配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高
用托盘天平称取25.20g NaCl
用100mL量筒量取5.2mL盐酸
用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高
溶液的pH:a<b<c<d 溶液的导电能力:a>b>d>c a、b溶液呈酸性 c、d溶液呈碱性
NaHCO3溶液中,一定有c(Na+)=c(HCO3-)+c(CO32-) 1 mol·L-1HCN溶液与1mol·L-1 NaOH溶液等体积混合后,测得所得溶液显酸性 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) 1mol/L.醋酸溶液加水稀释,所有离子浓度均减小
酸性:HCN>HClO pH:HClO<HCN 浓度:c(CN-)<c(ClO-) 与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
溶液的pH:a溶液的导电能力:a>b>d>c a、b溶液呈酸性 c、d溶液呈碱性
配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高 用托盘天平称取25.20 g NaCl 用100 mL的量筒量取5.2 mL的盐酸 用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高
溶液的上层浓度小,下层浓度大 溶液蒸干后,均能得到固体溶质 溶液中只有一种溶质时,溶液为纯净物 物质在溶解得到溶液的过程中,通常有放热或吸热的现象出现
溶液的pH:a<b<c<d 溶液的导电能力:a>b>d>c a、b溶液呈酸性 c、d溶液呈碱性
NaHCO3的溶液中有c (Na+)=c (HCO3-) + c (CO32-) + 2c (H2CO3) 25℃时,pH=2的CH3COOH与pH=12的NaOH等体积混合:c (Na+)> c(CH3COO-) pH=3的盐酸与pH=3的醋酸溶液中,水电离的c(H+)前者小 常温下,物质的量浓度相等的①NH4HCO3 ②(NH4)2CO3 ③NH4HSO4三种溶液中c (NH4+): ②>③>①
配制1L. 0.1 mol/L的NaCl溶液时用托盘天平称量5.85 g NaCl固体 配制一定物质的量浓度的NaOH溶液时,定容时仰视刻度线导致浓度偏低 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,立即转移到容量瓶中 容量瓶用蒸馏水洗净后,必须干燥方能用于配制溶液
硫酸溶液的体积为25 mL. b时刻溶液中SO 的浓度约为0.125 mol·L-1 d时刻溶液的pH为12 溶液的导电能力:c<d<b<a
的浓度约为0.125 mol·L-1 d时刻溶液的pH为12 溶液的导电能力:c<d<b<a
25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 同温度、同浓度的NaCl溶液和氨水的导电能力 25℃时,pH均为13的氨水和NaOH溶液中溶质的物质的量浓度
在0.1 mol·L.-1 NH4Cl溶液中:c(NH4+)=c(Cl-) 在0.1 mol·L.-1 NaHCO3溶液中:c(Na+)=c(HCO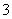 )+c(CO
)+c(CO )+c(H2CO3) pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 在0.1 mol·L.-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
)+c(H2CO3) pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 在0.1 mol·L.-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)

 )>c(OH-)>c(H+) 0.1 mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) pH=4的FeCl3溶液:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) pH=11的CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)
)>c(OH-)>c(H+) 0.1 mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) pH=4的FeCl3溶液:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) pH=11的CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)

 的浓度约为0.125 mol·L-1 d时刻溶液的pH为12 溶液的导电能力:c<d<b<a
的浓度约为0.125 mol·L-1 d时刻溶液的pH为12 溶液的导电能力:c<d<b<a
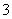 )+c(CO
)+c(CO )+c(H2CO3) pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 在0.1 mol·L.-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
)+c(H2CO3) pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 在0.1 mol·L.-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)