你可能感兴趣的试题
容器里气体的密度为40g·L-1 SO3的分解率为20% 在这10min内的平均反应速率vo2=0.005mol。L-1·min-1 化学反应速率vAg2SO4=vSO4
Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ 将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3- 将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: 2Al3++3SO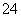 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
0.2mol · L-1 0.8 mol · L-1 l.5 mol · L-1 2 mol · L-1
Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ 将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3- 将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: 2Al3++3SO +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
混合气体中SO2的体积为0.448L(标况) 所得沉淀为0.05mol的BaSO4 aL.混合气体的物质的量为0.04mol a的取值范围为 0.672<a<0.896
混合气体的压强不再变化 混合气体的总质量不再变化 每生成2mol SO3的同时,消耗1mol SO2 每生成2mol SO2的同时,消耗2mol SO3
白色沉淀是CuI2,棕色溶液含有I2 滴加KI溶液时,转移2mol e- 时生成1mol白色沉淀 通入SO2时,SO2与I.—反应,I.—作还原剂 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
小于0.15mol 0.15mol 0.3mol 大于0.15mol,小于0.3mol
0.5mol·L-1NaHSO4与0.5mol·L-1Ba(OH)2混合至溶液呈中性:Ba2++OH—+SO42-+H+==BaSO4↓H2O 向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+ 硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O 用两个铜电极电解食盐水:2Cl-+2H2O=2OH-+H2↑+C12↑

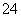 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓