
 C(s),则平衡移动的原因是增大压强 由图像关系可以判断,正反应为吸热反应 由平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1
C(s),则平衡移动的原因是增大压强 由图像关系可以判断,正反应为吸热反应 由平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1 C.(s) + D(g);ΔH>0(正反应为吸热反应)。下图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A.; ②加入催化剂;③加压;④升温;⑤减少C.,符合图示的条件是
C.(s) + D(g);ΔH>0(正反应为吸热反应)。下图所示为正、逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A.; ②加入催化剂;③加压;④升温;⑤减少C.,符合图示的条件是 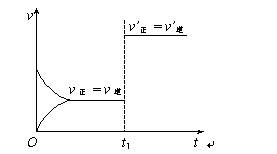
 A.②③ ①② ③④ ④⑤
A.②③ ①② ③④ ④⑤
 2SO3(g) ΔH<0 4NH3(g)+5O2(g)
2SO3(g) ΔH<0 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0 H2(g)+I2(g)
4NO(g)+6H2O(g) ΔH<0 H2(g)+I2(g) 2HI(g) ΔH>0 2A(g)+B.(g)
2HI(g) ΔH>0 2A(g)+B.(g) 2C(g) ΔH>0
2C(g) ΔH>0 

 2SO3(g) ΔH<0,t1时刻升高温度 4NH3(g)+5O2(g)
2SO3(g) ΔH<0,t1时刻升高温度 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0, t1 时刻增大O2浓度 C.(s)+H2O(g)
4NO(g)+6H2O(g) ΔH<0, t1 时刻增大O2浓度 C.(s)+H2O(g)  CO(g)+H2(g)ΔH>0,t1时刻升高温度 H2O(g)+CO(g)
CO(g)+H2(g)ΔH>0,t1时刻升高温度 H2O(g)+CO(g)  H2(g)+CO2(g) ΔH>0, t1时刻增大压强
H2(g)+CO2(g) ΔH>0, t1时刻增大压强
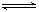 2SO3(g);ΔH<0 4NH3(g)+5O2(g)
2SO3(g);ΔH<0 4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0 H2(g)+I2(g)
4NO(g)+6H2O(g);ΔH<0 H2(g)+I2(g) 2HI(g); ΔH>0 C(s)+H2O(g)
2HI(g); ΔH>0 C(s)+H2O(g) CO(g)+H2(g);ΔH>0
CO(g)+H2(g);ΔH>0
 2SO3(g) ΔH<0 4NH3(g)+5O2(g)
2SO3(g) ΔH<0 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0 H2(g)+I2(g)
4NO(g)+6H2O(g) ΔH<0 H2(g)+I2(g) 2HI(g) ΔH>0 2A(g)+B(s)
2HI(g) ΔH>0 2A(g)+B(s) 2C(g) ΔH<0
2C(g) ΔH<0
 2SO3(g) ΔH<0 4 NH3(g)+5O2(g)
2SO3(g) ΔH<0 4 NH3(g)+5O2(g)  4NO(g)+6H2O(g) ΔH<0 H2(g)+I2(g)
4NO(g)+6H2O(g) ΔH<0 H2(g)+I2(g)  2HI(g) ΔH>0 2 NH3(g)
2HI(g) ΔH>0 2 NH3(g) N2(g) +3H2(g) ΔH>0
N2(g) +3H2(g) ΔH>0 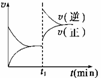
 2SO3(g) ΔH<0,t1时刻升高温度 4NH3(g)+5O2(g)
2SO3(g) ΔH<0,t1时刻升高温度 4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0,t1 时刻增大O2浓度 H2O(g)+CO(g)
4NO(g)+6H2O(g) ΔH<0,t1 时刻增大O2浓度 H2O(g)+CO(g)  H2(g)+CO2(g) ΔH>0, t1时刻增大压强 C.(s)+H2O(g)
H2(g)+CO2(g) ΔH>0, t1时刻增大压强 C.(s)+H2O(g)  CO(g)+H2(g) ΔH>0,t1时刻升高温度
CO(g)+H2(g) ΔH>0,t1时刻升高温度
 2SO3(g)H.<0 4NH3(g)+5O2(g)
2SO3(g)H.<0 4NH3(g)+5O2(g)  4NO(g)+6H2O(g)H.<0 H2(g)+I2(g)
4NO(g)+6H2O(g)H.<0 H2(g)+I2(g)  2HI(g)H.>0 N2(g) +3H2(g)
2HI(g)H.>0 N2(g) +3H2(g)  2 NH3(g)H.<0
2 NH3(g)H.<0 

 该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
 2SO3(g) △H.<0 4NH3(g)+5O2(g)
2SO3(g) △H.<0 4NH3(g)+5O2(g)  4NO(g)+6H2O(g) △H<0 H2(g)+I2(g)
4NO(g)+6H2O(g) △H<0 H2(g)+I2(g)  2HI(g) △H>0 N2(g) +3H2(g)
2HI(g) △H>0 N2(g) +3H2(g)  2 NH3(g) △H<0
2 NH3(g) △H<0