你可能感兴趣的试题
用烧碱溶液吸收Cl2:Cl2+2OH- =Cl-+ClO-+H2O 用饱和Na2CO3溶液转化锅垢中的CaSO4:CaSO4(s)+CO32- (aq)=CaCO3(s)+SO42-(aq) 实验室制备Fe(OH)3胶体:Fe3+ +3OH- =Fe(OH)3↓ 金属Na与水反应:Na +2H+ = H2↑+Na+
由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ 等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 氢气的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g) + O2(g) ΔH=+ 571.6 kJ·mol-1
S.比Cl2易与H2 化合 HCl比H2S 稳定 酸性HCl >H2S Cl的最高正价为+7,S.的最高正价为+6
22.4L氢气中含有的氢分子数目是NA 36gH2O含有的氧原子数目是2NA 1 mol/LBaCl2溶液中含有Cl-数目是2 NA 1mol H2在Cl2中完全燃烧转移的电子数是NA
2H2(g)+O2(g)==2H2O(g) △H.1 2H2(g)+O2(g)==2H2O(l) △H.2 S(g)+O2(g)==SO2(g) △H.1 S(s)+O2(g)==SO2(g) △H.2 C.(s)+  O2(g)==CO(g) △H.1C.(s)+ O2(g)==CO2(g) △H.2 H2(g)+ Cl2(g)==2HCl(g) △H.1
O2(g)==CO(g) △H.1C.(s)+ O2(g)==CO2(g) △H.2 H2(g)+ Cl2(g)==2HCl(g) △H.1  H2(g)+
H2(g)+  Cl2(g)==HCl(g) △H.2
Cl2(g)==HCl(g) △H.2
只有①②⑥ 只有②③④ 只有②④⑤⑥ 只有①②④⑤⑥
+184.6kJ/mol ―92.3 kJ/mol ―369.2 kJ/mol +92.3 kJ/mol
S(s) + O2 (g) =SO2 (g); △H1 S(g) + O2 (g) =SO2 (g);△H2 2H2(g) + O2 (g)= 2H2O(g);△H1 2H2 (g) + O2 (g) = 2H2O(l);△H2 CO(g) + 1/2 O2(g) = CO2(g);△H1 2CO(g) + O2(g) = 2CO2(g);△H2 H2 (g) +Cl2(g)=2HCl(g);△H1 1/2 H2(g) + 1/2 Cl2(g) = HCl(g);△H2
2H2(g)+O2(g) ==2H2O(l) △H1; 2H2(g)+O2(g) ==2H2O(g) △H2 N2(g)+3H2(g)  2NH3(g) △H1; CaCO3(s) == CaO(s)+CO2 (g) △H2 C.(s)+
2NH3(g) △H1; CaCO3(s) == CaO(s)+CO2 (g) △H2 C.(s)+ O2(g) == CO(g) △H1;C.(s)+O2(g) == CO2(g) △H2 H2(g)+Cl2(g) ==2HCl(g) △H1;
O2(g) == CO(g) △H1;C.(s)+O2(g) == CO2(g) △H2 H2(g)+Cl2(g) ==2HCl(g) △H1;  H2(g)+
H2(g)+ Cl2(g) == HCl(g) △H2
Cl2(g) == HCl(g) △H2
Na+(g)+Cl-(g)===NaCl(s) ΔH Na(s)+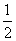 Cl2(g)===NaCl(s) ΔH1 Na(s)===Na(g) ΔH2 Na(g)-e-===Na+(g) ΔH3
Cl2(g)===NaCl(s) ΔH1 Na(s)===Na(g) ΔH2 Na(g)-e-===Na+(g) ΔH3
CuSO4·5H2O [Fe(SCN)2]Cl2 NH2Cl [Ag(NH3)2]OH
25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol, 则甲烷的燃烧热为Q kJ/mol CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的 ΔH<0 反应N2(g)+3H2(g) 2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
1 mol H2中的化学键断裂时需要吸收436 kJ能量 2 mol HCl分子中的化学键形成时要释放862 kJ能量 此反应的热化学方程式为:H2(g)+Cl2(g)===2HCl(g) ΔH.=+183 kJ/mol 此反应的热化学方程式为: H2(g)+
H2(g)+ Cl2(g)===HCl(g) ΔH.=-91.5 kJ/mol
Cl2(g)===HCl(g) ΔH.=-91.5 kJ/mol
+184.6kJ·mol-1 —369.2 kJ·mol-1 +92.3 kJ·mol-1 —92.3 kJ·mol-1
.H2和Cl2 Cu和Cl2 .H2和O2 Cu和O2

 O2(g)==CO(g) △H.1C.(s)+ O2(g)==CO2(g) △H.2 H2(g)+ Cl2(g)==2HCl(g) △H.1
O2(g)==CO(g) △H.1C.(s)+ O2(g)==CO2(g) △H.2 H2(g)+ Cl2(g)==2HCl(g) △H.1  H2(g)+
H2(g)+  Cl2(g)==HCl(g) △H.2
Cl2(g)==HCl(g) △H.2
 2NH3(g) △H1; CaCO3(s) == CaO(s)+CO2 (g) △H2 C.(s)+
2NH3(g) △H1; CaCO3(s) == CaO(s)+CO2 (g) △H2 C.(s)+ O2(g) == CO(g) △H1;C.(s)+O2(g) == CO2(g) △H2 H2(g)+Cl2(g) ==2HCl(g) △H1;
O2(g) == CO(g) △H1;C.(s)+O2(g) == CO2(g) △H2 H2(g)+Cl2(g) ==2HCl(g) △H1;  H2(g)+
H2(g)+ Cl2(g) == HCl(g) △H2
Cl2(g) == HCl(g) △H2
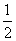 Cl2(g)===NaCl(s) ΔH1 Na(s)===Na(g) ΔH2 Na(g)-e-===Na+(g) ΔH3
Cl2(g)===NaCl(s) ΔH1 Na(s)===Na(g) ΔH2 Na(g)-e-===Na+(g) ΔH3
 2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
 H2(g)+
H2(g)+ Cl2(g)===HCl(g) ΔH.=-91.5 kJ/mol
Cl2(g)===HCl(g) ΔH.=-91.5 kJ/mol