你可能感兴趣的试题
元素的第一电离能越大,其金属性越强
元素的第一电离能越小,其金属性越强
金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关
同周期元素,第一电离能随原子序数增大逐渐增大
甲的金属性比乙强 乙的化合价为+1价 丙一定为非金属元素 丁一定是金属元素
的各级电离能数据如下: 则元素A.的常见价态是( ) A.+1 +2 +3 +6
第3周期所含的元素中钠的第一电离能最小 铝的第一电离能比镁的第一电离能大 在所有元素中,氟的电离能最大 钾的第一电离能比镁的第一电离能大
第一电离能的大小:Mg>Al。 锗的第一电离能高于碳而电负性低于碳 Ni是元素周期表中第28号元素,第2周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳 元素的第一电离能:Al
第一电离能越小,元素金属越强 第一电离能越小,该元素原子的能量越高 第一电离能越大,该元素的非金属性强 第一电离能失去的电子,一定是最外层上的电子
第3周期所含元素中钠的第一电离能最小 铝的第一电离能比镁的第一电离能大 在所有的元素中,F.的第一电离能最大 钾的第一电离能比镁的第一电离能大
族 ③R.元素第一电离能大于同周期相邻元素 ④R.元素基态原子的电子排布式为1s22s2 A.①② ②③ ③④ ①④
HF、HCl、H2S、PH3的稳定性依次增强 按Mg、Si、N.、F.的顺序,原子半径由小变大 某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA.族 在①P.、S.,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
第一电离能的周期性递变规律是原子半径、化合价、电子排布周期性变化的结果 通常元素的第一电离能为正值,第二电离能为负值 电负性是相对的,所以没有单位 分析元素电负性数值可以看出,金属元素的电负性较大,非金属元素的电负性较小
第一电离能是原子失去核外第一个电子需要的能量
在元素周期表中,主族元素的第一电离能从左到右越来越大
可通过各级电离能的数值,判断元素可能的化合价
第一电离能越大的元素,其电负性越大
Q和R S和T
T和U R和U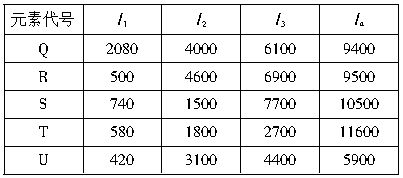
钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必定依次增大 最外层电子排布为ns2np6(若只有K.层时为1s2)的原子,第一电离能较大 对于同一元素而言,原子的逐级电离能越来越大
钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 最外层电子排布为ns2np6(当只有K.层时为1s2)的原子,第一电离能较大 对于同一元素而言,原子的电离能I.123<…

