你可能感兴趣的试题
乙烯与氯气加成反应的产物是Cl—CH2—CH2—Cl 苯分子中含有三个 -C.键和三个C.=C.键 C.甲烷与氯气的混合气体在光照下反应,生成的是一氯甲烷和氯化氢 某有机物完全燃烧后生成CO2和H2O,则该物质必定含有碳、氢、氧三 种元素
“操作X”为结晶 “操作Y”为蒸发浓缩并灼烧 \ 电解时阳极的电极反应式为2Cl--2e-=Cl2↑ 电解产生的炽热的镁粉需在CO2气氛中冷却
乙烯与氯气加成反应的产物是Cl―CH2―CH2―Cl 苯分子中含有三个 -C.键和三个C.=C.键 C.甲烷与氯气的混合气体在光照下反应,生成的是一氯甲烷和氯化氢 某有机物完全燃烧后生成CO2和H2O,则该物质必定含有碳、氢、氧三种元素
实验①、②所涉及的物质均为电解质 实验②、③均为放热反应实验 ②、③均未发生氧化还原反应 实验①、③反应制得的物质均为纯净物
第①组反应的其余产物为H2O 第②组反应中Cl2与FeBr2的物质的量之比小于或等于1 : 2 第③组反应中生成1 mol Cl2,转移电子5 mol 氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2
2Ag(s)+Cl2(g)═2AgCl(s) Ag(g)+Cl2(g)═AgCl(s) Ag(s)+Cl2(g)═AgCl(s) Ag+(aq)+Cl-(aq)═AgCl(s)
只有①②⑥ 只有②③④ 只有②④⑤⑥ 只有①②④⑤⑥
实验①、②所涉及的物质均为电解质 实验②、③均为放热反应实验 ②、③均未发生氧化还原反应 实验①、③反应制得的物质均为纯净物
第①组反应的其余产物为H2O和O2 第②组反应中Cl2与FeBr2的物质的量之比为1∶2 第③组反应中生成1 mol Cl2,转移电子2 mol 氧化性由强到弱顺序为MnO >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
其原子半径比氯的原子半径大 其简单阴离子的还原性比Cl-弱 其单质的氧化性比Cl2强 其氢化物的稳定性比HCl强
实验①、②所涉及的物质均为电解质 ②、③均未发生化学反应 实验①、③反应制得的物质均为纯净物 实验①中发生的反应既是化合反应又是氧化还原反应
上述反应中,每生成l mol SO42-,可脱去1 mol Cl2 H2O参与该反应,既不做氧化剂又不做还原剂 根据该反应可判断氧化性:Cl2 > SO42- 该反应中还原剂是S2O32-
25 ℃,NaHCO3在水中的溶解度比Na2CO3的大 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 图中所示转化反应都是氧化还原反应 
实验①、③反应制得的物质均为纯净物 实验①中的反应既是氧化还原反应,又是四种基本反应类型中的反应 实验③化学方程式为FeCl3+3H2O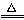 Fe(OH)3↓+3HCl 实验①、②所涉及的物质均为电解质
Fe(OH)3↓+3HCl 实验①、②所涉及的物质均为电解质 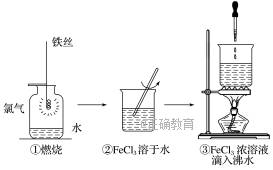
实验①.③反应制得的物质均为纯净物 实验②.③均未发生氧化还原反应 实验②.③均为放热反应 实验①.②所涉及的物质均为电解质或非电解质
Cl2是一种黄绿色、密度比空气大的有毒气体 Cl2能与水反应生成盐酸和次氯酸 工业上用Cl2和石灰水为原料制造漂白粉 红热的铁丝在Cl2中剧烈燃烧,产生棕色烟
B.C.三种气体,各是Cl2、HCl、HBr中某种气体。已知A. 混合不反应,则下列推断正确的是()A.A.B.能确定B. 可能是HClC.C.不是Cl2,也不是HBr C.肯定不是HC
Cl2是一种黄绿色、密度比空气大的有毒气体 红热的铁丝在Cl2中剧烈燃烧,产生白色烟雾 工业上用Cl2和石灰乳为原料制造漂白粉 Cl2能与水反应生成盐酸和次氯酸

 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2

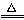 Fe(OH)3↓+3HCl 实验①、②所涉及的物质均为电解质
Fe(OH)3↓+3HCl 实验①、②所涉及的物质均为电解质 