你可能感兴趣的试题
Zn为电池的负极 正极反应式为:2FeO42- + 10H+ +6e- =Fe2O3 +5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时OH- 向负极迁移
放电时负极反应式为Zn-2e-===Zn2+ 放电时正极反应式为FeO42-+4H2O+3e-===Fe(OH)3+5OH- 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 充电时阳极附近溶液的碱性增强
电子由Zn电极流出,经KOH溶液流向正极 正极反应式为2Fe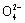 +
+ =Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时OH-向负极迁移
=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时OH-向负极迁移
Zn为电池的负极 正极反应式为2FeO +10H++6e-===Fe2O3+5H2O 该电池放电过程中电解质溶液浓度增大 电池工作时OH-向负极迁移
+10H++6e-===Fe2O3+5H2O 该电池放电过程中电解质溶液浓度增大 电池工作时OH-向负极迁移
Zn为电池的负极 正极反应式为2Fe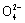 +
+ 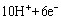 =Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时
=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时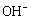 向正极迁移
向正极迁移
Zn为电池的正极 充电时阳极反应为:Fe(OH)3-3e+5OH =FeO42-+4H2O 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 该电池放电过程中电解质溶液浓度不变
Zn为电池的负极 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时OH-向负极迁移
电池工作时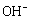 向正极迁移 正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 Zn为电池的负极
向正极迁移 正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 Zn为电池的负极
Zn为电池的负极 正极反应式为 2Fe O42- +10H++6e- = Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时OH-向正极迁移
Zn为电池的负极 正极反应式为2FeO42− + 10H+ + 6e− = Fe2O3 + 5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时K+ 向负极迁移
放电时负极反应式为Zn+2OH--2e- = Zn(OH)2 放电时正极反应式为 FeO42-+4H2O+3e-= Fe(OH)3+5OH- 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 充电时阳极附近溶液的碱性减弱
电池工作时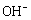 向正极迁移 正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 Zn为电池的负极
向正极迁移 正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 Zn为电池的负极
放电时,正极区溶液的pH减小 放电时,负极反应式为3Zn﹣6e﹣+6OH﹣═3Zn(OH)2 充电时,每转移3mol电子,阳极有1mol Fe(OH)3被还原 充电时,电池的锌电极接电源的正极
放电时,正极区溶液的pH减小 放电时,负极反应式为3Zn-6e-+6OH-=3Zn(OH)2 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 充电时,电池的锌电极接电源的正极

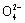 +
+ =Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时OH-向负极迁移
=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时OH-向负极迁移
 +10H++6e-===Fe2O3+5H2O 该电池放电过程中电解质溶液浓度增大 电池工作时OH-向负极迁移
+10H++6e-===Fe2O3+5H2O 该电池放电过程中电解质溶液浓度增大 电池工作时OH-向负极迁移
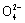 +
+ 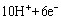 =Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时
=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 电池工作时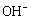 向正极迁移
向正极迁移
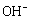 向正极迁移 正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 Zn为电池的负极
向正极迁移 正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 Zn为电池的负极
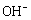 向正极迁移 正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 Zn为电池的负极
向正极迁移 正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O 该电池放电过程中电解质溶液浓度不变 Zn为电池的负极