你可能感兴趣的试题
B.两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是( ) A.该化合物的化学式是Al2Cl6 该化合物是离子化合物,在熔融状态下能导电 该化合物在潮湿空气中不易变质 该化合物中不存在离子键,也不含有非极性共价键
A.该化合物的化学式是Al2Cl6 该化合物是离子化合物,在熔融状态下能导电 该化合物在潮湿空气中不易变质 该化合物中不存在离子键,也不含有非极性共价键
全部由非金属元素组成的化合物中可含离子键 H2O中所有原子都满足八电子稳定状态 两种元素构成的化合物可以含有非极性共价键 CH4中所有的电子都参与形成共价键
含有共价键的化合物一定是共价化合物 只有非金属原子间才能形成共价键 由共价键形成的一定是共价化合物分子 分子中只有共价键的化合物一定是共价化合物
①②⑤正确 都不正确 ④正确,其他不正确 仅①不正确
以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键 NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构 24Mg34S晶体中电子总数与中子总数之比为1∶1
含有共价键的化合物一定是共价化合物 不同元素原子形成的多原子分子中,含有的化学键只能是极性共价键 非极性共价键只能存在于非金属单质或共价化合物中 含有离子键的化合物一定是离子化合物
CO2、HCl、BF3三种分子中,每个原子的最外层都具有8电子稳定结构 通过化合物在熔融状态下的导电性实验,可确定是离子化合物还是共价化合物 因为氮气的键能比氧气的键能大,所以氮气的沸点比氧气的高 分子晶体中不一定含有共价键,只含共价键的化合物一定是分子晶体
含有共价键的化合物一定是共价化合物 分子中只有共价键的化合物一定是共价化合物 由共价键形成的分子一定是共价化合物 只有非金属原子间才能形成共价化合物
CO2溶于水时,需克服共价键和分子间作用力 CCl4、C2H4、SiO2都存在共价键,它们都是共价化合物 某物质在熔融状态能导电,则该物质中一定含有阴离子 CO2和N2中,每个原子的最外层都具有8电子稳定结构
离子晶体一定含金属阳离子 非金属元素形成的单质一定是分子晶体 在共价化合物分子中各原子都形成8电子结构 共价键能存在于共价化合物中,也能存在于离子化合物中
K.、L.、M.三元素的金属性逐渐增强 在RCl2分子中,各原子均满足8电子的稳定结构 Q.元素的最高价氧化物为电解质,其水溶液能够导电 K.在T.单质中燃烧所形成的化合物中含有非极性共价键和离子键
含有共价键的化合物可能是共价化合物 在共价化合物中可能存在离子键 含有离子键的化合物中一定是没有共价键 难失电子的原子,获得电子的能力一定强
含有共价键的化合物一定是共价化合物 共价化合物中一定含有共价键 含有离子键的化合物一定是离子化合物 双原子单质分子中的共价键一定是非极性键
含有共价键的化合物可能是共价化合物 含有离子键的化合物中可能存在共价键 含有离子键的化合物中一定没有共价键 难失电子的原子,获得电子的能力一定强
B.两种元素都是第3周期的元素,分子中所有原子的最外层电子数都达到8个电子的稳定结构。下列说法不正确的是( ) 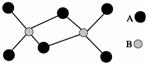 A.该化合物的化学式是Al2Cl6 该化合物是离子化合物,在熔融状态下能导电 该化合物在固态时所形成的晶体是分子晶体 该化合物中不存在离子键,也不含有非极性共价键
A.该化合物的化学式是Al2Cl6 该化合物是离子化合物,在熔融状态下能导电 该化合物在固态时所形成的晶体是分子晶体 该化合物中不存在离子键,也不含有非极性共价键
共价化合物中原子都一定满足最外层8电子结构 通过共价键形成的分子一定是共价化合物 共价化合物中可能含有离子键 微粒间通过共价键形成的晶体,具有较高的熔、沸点
H2O分子之间的作用力大于H2S,故前者比后者稳定 NaHSO4属于含有共价键的离子化合物,加热融化时破坏了该物质中的离子键和共价键 某晶体固态不导电,熔化时能导电,该晶体一定是离子晶体 CO2、N2都是所有原子最外层都满足8电子结构的共价化合物
Na2O和Na2O2的化学键类型相同,其中阴、阳离子的个数比也相同 通过化合物在熔融状态下的导电性实验,可确定是离子化合物还是共价化合物 HClO和PCl3的分子结构中,每个原子最外层都具有8电子稳定结构 SO2水溶液能导电,是因为SO2分子中共价键破坏而发生电离

 A.该化合物的化学式是Al2Cl6 该化合物是离子化合物,在熔融状态下能导电 该化合物在潮湿空气中不易变质 该化合物中不存在离子键,也不含有非极性共价键
A.该化合物的化学式是Al2Cl6 该化合物是离子化合物,在熔融状态下能导电 该化合物在潮湿空气中不易变质 该化合物中不存在离子键,也不含有非极性共价键
 A.该化合物的化学式是Al2Cl6 该化合物是离子化合物,在熔融状态下能导电 该化合物在固态时所形成的晶体是分子晶体 该化合物中不存在离子键,也不含有非极性共价键
A.该化合物的化学式是Al2Cl6 该化合物是离子化合物,在熔融状态下能导电 该化合物在固态时所形成的晶体是分子晶体 该化合物中不存在离子键,也不含有非极性共价键