
 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的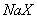 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 
 已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1 mol·L.-lA.1Cl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 mol·L.-l 25℃时0.2 mol·L.-l HC1溶液与等体积0.05 mol·L.-l Ba(OH)2溶液混合后,溶液的pH约为1 0.1mol·L.-l NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A.)
已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1 mol·L.-lA.1Cl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 mol·L.-l 25℃时0.2 mol·L.-l HC1溶液与等体积0.05 mol·L.-l Ba(OH)2溶液混合后,溶液的pH约为1 0.1mol·L.-l NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A.)
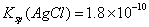 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
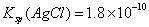 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有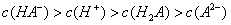
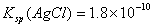 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到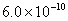 mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有
mol·L-1 C.25°时,0.1mol·L-1Na2CO3溶液中水电离出来的OH-浓度大于0.1mol·L-1NaOH溶液中水电离出来的OH-浓度 室温下,0.1mol·L-1NaHA溶液的pH=4,则有