你可能感兴趣的试题
CH4-O2燃料电池 C2H5OH-O2燃料电池 H2-O2燃料电池 CO-O2燃料电池
放电过程中,Na+从右向左迁移 a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O b电极的电极反应式为:H2O2+2e-+2H+=2H2O 每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6N.A个
电极 材料中含MnO2层,MnO2可增强导电性 B.电池负极区的电极反应为: BH4 + 8OH
+ 8OH —8e
—8e = BO
= BO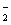 + 6H2O 放电过程中,Na+从正极区向负极区迁移 在电池反应中,每消耗1L 6 mol/LH2O2溶液, 理论上流过电路中的电子为6N.A个
+ 6H2O 放电过程中,Na+从正极区向负极区迁移 在电池反应中,每消耗1L 6 mol/LH2O2溶液, 理论上流过电路中的电子为6N.A个
O2—CH4燃料电池 O2—C2H5OH燃料电池 O2—H2燃料电池 O2—CO燃料电池
O2—CH4燃料电池 O2—C2H5OH燃料电池 O2—H2燃料电池 O2—CO燃料电池
该电池工作时电能转化为化学能 该电池中电极a是正极 外电路中电子由电极a通过导线流向电极b 该电池的总反应:H2+O2=H2O
该装置将化学能转化为电能 为了增加灯泡亮度,可以将电极碳棒变得多粗糙多孔 电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a 该电池的总反应:2H2+O2=2H2O
氢氧燃料电池可将热能直接转变为电能 燃料电池的能量转化率可达100% 氢氧燃料电池工作时氢气在负极被氧化 以KOH溶液为电解质溶液的氢氧燃料电池,负极反应为O2 + 2H2O + 4e- =4OH-
正极反应式为:O2+2H2O+4e- =4OH- 工作一段时间后,电解液中的KOH的物质的量不变 该燃料电池的总反应方程式为:2H2+O2 =2H2O 氢氧燃料电池可将热能直接转变为电能
CH4—O2燃料电池 C2H5OH—O2燃料电池 H2—O2燃料电池 CO—O2燃料电池
电极a采用MnO2,MnO2既作电极材料又有催化作用 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4 电池放电时Na+从b极区移向a极区 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
电极 是燃料电池的负极
B.电池的电极A.反应为:BH4-+8OH--8e-===BO2-+6H2O
放电过程中,Na+从正极区向负极区迁移
在电池反应中每消耗1L. 6 mol/L H2O2溶液,理论上流过电路中的电子为6N.A个
肼是燃料电池的负极反应物,O2是正极反应物 肼燃料电池的正极反应为 O2 + 2H2O + 4e-= 4OH- 肼燃料电池的负极反应为:N2H4 —4e—=N2↑+4H+ 电池工作过程中H+向正极移动,但H+物质的量不变
放电过程中,Na+从右向左迁移 a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O b电极的电极反应式为:H2O2+2e-+2H+=2H2O 每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6N.A个
该电池工作时电能转化为化学能 有1mol电子转移时,反应的氧气为5.6L 外电路中电流由电极b通过导线流向电极a 电极b的反应为:O2+4e-+H2O=4OH-
电极 是燃料电池的负极
B.电池的电极A.反应为:BH4-+8OH--8e-===BO2-+6H2O
放电过程中,Na+从正极区向负极区迁移
在电池反应中,每消耗1L. 6 mol/L H2O2溶液,理论上流过电路中的电子为6N.A个
a极为电池的正极 电池工作时电流由a极沿导线经灯泡再到b极 电池正极的电极反应为:4H++ O2 +4e—= 2H2O 电池工作时,1mol二甲醚被氧化时就有6mol电子转移
碱性燃料电池 磷酸燃料电池 熔融碳酸盐燃料电池 固态氧化物燃料电池 质子交换膜燃料电池

 + 8OH
+ 8OH —8e
—8e = BO
= BO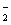 + 6H2O 放电过程中,Na+从正极区向负极区迁移 在电池反应中,每消耗1L 6 mol/LH2O2溶液, 理论上流过电路中的电子为6N.A个
+ 6H2O 放电过程中,Na+从正极区向负极区迁移 在电池反应中,每消耗1L 6 mol/LH2O2溶液, 理论上流过电路中的电子为6N.A个