你可能感兴趣的试题
a=b 混合溶液的PH=7 混合溶液中,c(H+)=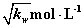 混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
HB的电离平衡常数Ka(HA)>Ka(HB)。下列有关说法正确的是( ) A.等温浓度均为0.1 mol·L-1的HA.HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) 在0.1mol·L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) 等体积pH相同的HA.HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 等温浓度均为0.1 mol·L-1的NaA.NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB)
H HC,其中HA的c(H+)=0.001 mol /L.,HB的电离度为0.1%,HC的c(OH-)=1×10-12mol /L.,则室温下三种酸所形成的钠盐:NaA.NaB.NaC的溶液在物质的量浓度相同的情况下,其pH值由大到小的顺序是( ) A.NaA>NaB>NaCB.NaB>NaA>NaC NaB>NaC>NaA NaC>NaA>NaB
-,下列叙述不正确的是( )。 A.溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-) 0.10 mol/L的HA溶液中加水稀释,溶液中c(A-)减小 HA溶液中加少量的NaA固体,平衡逆向移动 常温下,加入NaA固体可使HA的电离常数增大
该一元酸溶液的pH=1 该溶液中由水电离出的c(H+)=1×10-11mol・L.―1 该溶液中水的离子积常数为1×10-22 用pH=11的NaOH溶液V1L与V2L0.1 mol・L.―1该一元酸(HA)溶液混合,若混合 溶液的pH=7,则V1<V2
c(Na+)>c(A-)>c(H+)>c(OH-) c(Na+)>c(OH-)>c(A-)>c(H+) c(Na+)+ c(OH-)= c(A-)+ c(H+) c(Na+)+ c(H+) = c(A-)+ c(OH-)
-,下列叙述不正确的是 A. 溶液中离子浓度的关系满足:c(H+)= c(OH-)+ c(A-) 0.10 mol/L的HA溶液中加水稀释,溶液中c(OH-)增大 HA溶液中加少量的NaA固体,平衡逆向移动 常温下,加入NaA固体可使HA的电离常数变小
溶液中由水电离出的c(H+)=1×10-10 mol·L-1 溶液中存在HA H++A- 与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
H++A- 与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
c(Na+) > c(A-) > c(H+) > c(OH-) c(Na+) > c(A-) > c(OH-) > c(H+) c(Na+) + c(OH-) = c(A-) + c(H+) c(Na+) + c(H+) = c(A-) + c(OH-)
c(Na+)>c(A-)>c(H+)>c(OH-) c(Na+)>c(OH-)>c(A-)>c(H+) c(Na+)+c(OH-)=c(A-)+c(H+) c(Na+)+c(H+)=c(A-)+c(OH-)
相同条件下HA溶液的导电性弱于盐酸 0.1mol/L的HA溶液pH为3 HA溶液中滴加石蕊显红色 NaA溶液显碱性

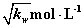 混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
 H++A- 与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
H++A- 与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大