你可能感兴趣的试题
若将该反应设计成原电池,反应时化学能转化为电能 ΔH.的值与反应方程式的化学计量数有关 若将该反应设计成原电池,铁棒为负极 若将其设计为原电池,当有28gFe溶解时,正极放出气体的体积11.2L.
Zn和H2SO4的总能量大于 Zn SO4和H2的总能量 反应过程中能量关系可用下图表示 若将该反应设计成原电池,则Zn为负极 若将该反应设计成原电池,当有32.5g锌溶解时,正极放出11.2L气体
稀HCl和NaOH溶液反应的中和热ΔH.=-57.3 kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应的热化学方程式为: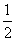 H2SO4(aq)+
H2SO4(aq)+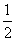 Ba(OH)2(aq)===
Ba(OH)2(aq)===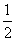 BaSO4(s)+H2O(l) ΔH.=-57.3 kJ/mol 1 mol CO(g)完全燃烧时放出的热量为283.0 kJ, 则2CO2(g)===2CO(g)+O2(g)反应的 ΔH.=+566.0 kJ/mol 需要加热才能发生的反应一定是吸热反应 NaOH溶液与稀H2SO4反应中和热的热化学方程式为 2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH.=-114.6 kJ/mol
BaSO4(s)+H2O(l) ΔH.=-57.3 kJ/mol 1 mol CO(g)完全燃烧时放出的热量为283.0 kJ, 则2CO2(g)===2CO(g)+O2(g)反应的 ΔH.=+566.0 kJ/mol 需要加热才能发生的反应一定是吸热反应 NaOH溶液与稀H2SO4反应中和热的热化学方程式为 2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH.=-114.6 kJ/mol
NaOH(aq)+HCl(aq)====NaCl(aq)+H2O(l);ΔH1 NaOH(aq)+1/2H2SO4(aq) ====1/2Na2SO4(aq)+H2O(l);ΔH2 CH3COOH(aq)+NaOH(aq) ====CH3COONa(aq)+H2O(l);ΔH3 NaOH(aq)+1/2H2SO4(浓) ====1/2Na2SO4(aq)+H2O(l);ΔH4
反应过程中能量关系如图表示,则该反应为 放热反应 若将该反应设计成原电池,锌为负极 化学反应的焓变与反应方程式的计量数有关 若将其设计为原电池,当有32.5g锌溶解时, 正极放出气体体积为11.2L
1 molZn的能量高于1 molH2的能量 反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量 如果Zn足量,反应速率会经历由慢到快到慢的过程 用锌粉代替锌粒,速率会加快
KOH(aq)+ H2SO4(aq)===
H2SO4(aq)=== K2SO4(aq)+H2O(l) ΔH.=-11.46 kJ/mol 2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l)ΔH.=-11.46 kJ/mol 2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l)ΔH.=-114.6 kJ/mol KOH(aq)+
K2SO4(aq)+H2O(l) ΔH.=-11.46 kJ/mol 2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l)ΔH.=-11.46 kJ/mol 2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l)ΔH.=-114.6 kJ/mol KOH(aq)+ H2SO4(aq)===
H2SO4(aq)=== K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ/mol
K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ/mol
在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量 甲烷的燃烧热ΔH.=-890 kJ·mol-1,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH.=-890 kJ·mol-1 已知常温常压下:HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1,则有:H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1 已知:S(s)+O2(g)===SO2(g) ΔH1=-Q1 kJ·mol-1,S(g)+O2(g)===SO2(g) ΔH2=-Q2 kJ·moI-1,则Q12
该反应是放热反应 ΔH的值与反应方程式的计量系数有关 若将该反应设计成原电池则锌为负极 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
Zn和H2SO4的总能量大于ZnSO4和H2的总能量 反应过程中能量关系可用上图表示 若将该反应设计成原电池,则Zn为负极 若将该反应设计成原电池,当有32.5g锌溶解时, 正极放出11.2L.气体
Zn和H2SO4的总能量大于ZnSO4和H2的总能量 反应过程中能量关系可用右图表示 若将该反应设计成原电池,则Zn为负极 若将该反应设计成原电池,当有32.5g锌溶解时,正极放出11.2L.气体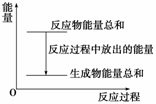
活化能的大小对化学反应前后的能量变化不产生影响 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H= +2 x283.0kJ/mol
对于2SO2(g)+O2(g) 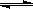 2SO3(g) ΔH.=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 热化学方程式中的化学计量数不能用分数表示 Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH.<0,该反应的化学能可以转化为电能 ΔH.的大小与热化学方程式的化学计量数无关
2SO3(g) ΔH.=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 热化学方程式中的化学计量数不能用分数表示 Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH.<0,该反应的化学能可以转化为电能 ΔH.的大小与热化学方程式的化学计量数无关
Zn和H2SO4的总能量大于ZnSO4和H2的总能量 反应过程中能量关系可用上图表示 若将该反应设计成原电池,则Zn为负极 若将该反应设计成原电池,当有32.5g锌溶解时, 正极放出11.2L.气体
反应过程中能量关系如右图所示,则该反应为放热反应 化学反应的反应热与反应方程式的计量数有关 若将该反应设计成原电池,锌为负极 若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2L.
NaOH(aq)+HCl(aq)=NaCl(aq )+H2O(l);△H1 NaOH(aq)+ H2SO4(aq)=
H2SO4(aq)= Na2SO4(aq)+H2O(l);△H2 CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3 NaOH(aq)+
Na2SO4(aq)+H2O(l);△H2 CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3 NaOH(aq)+ H2SO4(浓)=
H2SO4(浓)= Na2SO4(aq)+H2O(l);△H4
Na2SO4(aq)+H2O(l);△H4
Zn和H2SO4的总能量大于ZnSO4和H2的总能量 反应过程中能量关系可用上图表示 若将该反应设计成原电池,则Zn为负极 若将该反应设计成原电池,当有32.5g锌溶解时正极放出11.2L.气体
反应过程中能量关系可用右图表示 ΔH.的值与反应方程式的计量系数有关 若将该反应设计成原电池锌为负极 若将其设计为原电池当有32.5g锌溶解时, 正极放出气体一定为11.2L

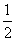 H2SO4(aq)+
H2SO4(aq)+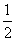 Ba(OH)2(aq)===
Ba(OH)2(aq)===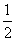 BaSO4(s)+H2O(l) ΔH.=-57.3 kJ/mol 1 mol CO(g)完全燃烧时放出的热量为283.0 kJ, 则2CO2(g)===2CO(g)+O2(g)反应的 ΔH.=+566.0 kJ/mol 需要加热才能发生的反应一定是吸热反应 NaOH溶液与稀H2SO4反应中和热的热化学方程式为 2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH.=-114.6 kJ/mol
BaSO4(s)+H2O(l) ΔH.=-57.3 kJ/mol 1 mol CO(g)完全燃烧时放出的热量为283.0 kJ, 则2CO2(g)===2CO(g)+O2(g)反应的 ΔH.=+566.0 kJ/mol 需要加热才能发生的反应一定是吸热反应 NaOH溶液与稀H2SO4反应中和热的热化学方程式为 2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH.=-114.6 kJ/mol

 H2SO4(aq)===
H2SO4(aq)=== K2SO4(aq)+H2O(l) ΔH.=-11.46 kJ/mol 2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l)ΔH.=-11.46 kJ/mol 2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l)ΔH.=-114.6 kJ/mol KOH(aq)+
K2SO4(aq)+H2O(l) ΔH.=-11.46 kJ/mol 2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l)ΔH.=-11.46 kJ/mol 2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l)ΔH.=-114.6 kJ/mol KOH(aq)+ H2SO4(aq)===
H2SO4(aq)=== K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ/mol
K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ/mol

 2SO3(g) ΔH.=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 热化学方程式中的化学计量数不能用分数表示 Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH.<0,该反应的化学能可以转化为电能 ΔH.的大小与热化学方程式的化学计量数无关
2SO3(g) ΔH.=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 热化学方程式中的化学计量数不能用分数表示 Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH.<0,该反应的化学能可以转化为电能 ΔH.的大小与热化学方程式的化学计量数无关
 H2SO4(aq)=
H2SO4(aq)= Na2SO4(aq)+H2O(l);△H2 CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3 NaOH(aq)+
Na2SO4(aq)+H2O(l);△H2 CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3 NaOH(aq)+ H2SO4(浓)=
H2SO4(浓)= Na2SO4(aq)+H2O(l);△H4
Na2SO4(aq)+H2O(l);△H4