

 A. 该反应是放热反应 B. b点时混合气体的平均摩尔质量不再变化 T.
A. 该反应是放热反应 B. b点时混合气体的平均摩尔质量不再变化 T. 温度下a点表示若想达到平衡,可以采取增大压强的方法 c点可表示v(正)
温度下a点表示若想达到平衡,可以采取增大压强的方法 c点可表示v(正)

 该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示 的转化率, 图中有a、b、c三点,如图所示,则下列描述正确的是: A.该反应是放热反应 B.b点时混合气体的平均摩尔质量不再变化 T1温度下a点表示若想达到平衡,可以采取增大压强的方法 c点可表示v(正)<v(逆)
该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示 的转化率, 图中有a、b、c三点,如图所示,则下列描述正确的是: A.该反应是放热反应 B.b点时混合气体的平均摩尔质量不再变化 T1温度下a点表示若想达到平衡,可以采取增大压强的方法 c点可表示v(正)<v(逆)
 x (g)在不同温度和压强下,反应物A.的转化率变化情况。下列判断正确的是 ( ) A.m>x,正反应为放热反应 B.m+n<x,正反应为吸热反应 C.m<x,正反应为放热反应 m>x,正反应为吸热反应
x (g)在不同温度和压强下,反应物A.的转化率变化情况。下列判断正确的是 ( ) A.m>x,正反应为放热反应 B.m+n<x,正反应为吸热反应 C.m<x,正反应为放热反应 m>x,正反应为吸热反应

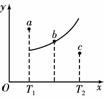 A.该反应是放热反应 B.b点时混合气体的平均摩尔质量不再变化 T.1温度下若由a点达到平衡,可采取增大压强的方法 c点v正>v逆
A.该反应是放热反应 B.b点时混合气体的平均摩尔质量不再变化 T.1温度下若由a点达到平衡,可采取增大压强的方法 c点v正>v逆